Meerwein-Arylierung
Die Meerwein-Arylierung – auch Meerwein-Reaktion genannt – ist eine Namensreaktion der organischen Chemie, die auf den deutschen Chemiker Hans Meerwein (1879–1965) zurückgeht. Die Reaktion wurde erstmals 1939 veröffentlicht.[1]
Übersichtsreaktion
Bei der Meerwein-Arylierung wird ein Aryldiazoniumsalz (z. B. Phenyldiazoniumchlorid) mit einem Alken (1) unter Zugabe von Kupfersalzen z. B. Kupfer(II)-chlorid (CuCl2) zu Reaktion gebracht. Es entsteht entweder ein Gemisch aus cis- und trans-3-Phenylacryl (cis,trans-2) und/oder 2-Chlor-3-phenylpropan (3):[1]
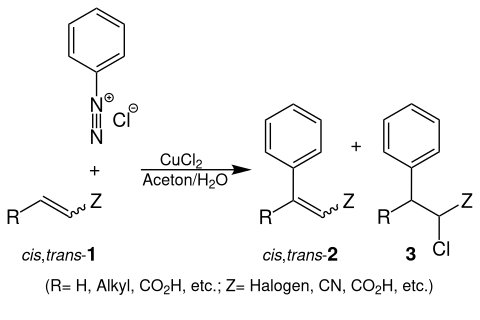
Reaktionsmechanismus
Ein möglicher Reaktionsmechanismus für die Meerwein-Arylierung wird von Zerong Wang wie folgt beschrieben:[1]

Das Aryldiazoniumsalz reagiert unter Zugabe von Kupfer(I)-chlorid (CuCl) zu einem Phenylradikal, dabei bildet sich Stickstoff (N2) und Kupfer(II)-chlorid (CuCl2). Das Phenylradikal reagiert unter Zugabe eines Alkens (1) zu einem Phenylpropanradikal. Das Radikal reduziert das Kupfer(II)-chlorid (CuCl2) zu Kupfer(I)-chlorid (CuCl) und bildet am Phenylpropan ein Carbeniumion welches entweder durch Abspalten eines Protons zu 3-Phenylacrylsäure (Z = CO2H; cis,trans-2) reagiert oder durch Reaktion mit einem Chlorid-Ion und zu 2-Chlor-3-phenylpropionsäure (Z = CO2H; 3).
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Volume 2. John Wiley, Hoboken (N.J.) 2009, ISBN 978-0-470-28662-3, S. 1866–1870.