Konformitätsbewertung
Konformitätsbewertung ist in der internationalen Norm ISO/IEC 17000 „Konformitätsbewertung – Begriffe und allgemeine Grundlagen“ definiert als „Darlegung, dass festgelegte Anforderungen bezogen auf ein Produkt, einen Prozess, ein System, eine Person oder eine Stelle erfüllt sind“.
Allgemein
Konformitätsbewertung ist ein Überbegriff für Tätigkeiten des Auswählens, Ermittelns (von Eigenschaften), Bewertens (etwa auf Einhaltung vorgegebener oder allgemeiner Anforderungen) und Bestätigens (etwa durch Erklärung des Herstellers, oder ein Zertifikat einer Zertifizierungsstelle, dass ein Produkt bestimmte Normen einhält). Solche Tätigkeiten sind beispielsweise Stichprobennahme, Prüfen, Inspizieren, Erklären, Zertifizieren. Die Objekte der Konformitätsbewertung sind nicht eingeschränkt.
Konformitätsbewertung findet auf vielfältige Weise und allen Ebenen statt:
- im Betrieb (etwa Endprüfung, Auditierung eines Qualitätsmanagementsystems durch eigene Auditoren): >> First Party
- durch Stellen / Personen des Kunden oder Abnehmers: >> Second Party
- durch kommerzielle, vom Auftraggeber unabhängige Konformitätsbewertungsstellen (etwa Laboratorien; Zertifizierungsstellen; Inspektionsstellen; Akkreditierungsstellen): >> Third Party
Konformitätsbewertung findet sowohl auf rechtlich ungeregelter Basis statt (etwa als entwicklungsbegleitende Prüfung oder als Bestätigung von Eigenschaften in einem Vertragsverhältnis, so genannter „freiwilliger Bereich“, etwa Zertifizierung als „Bioland-Betrieb“) als auch auf der Grundlage gesetzlicher Regelungen (so genannter „geregelter Bereich“). Konformitätsbewertungen im geregelten Bereich können freiwillig sein (etwa: das Öko-Audit) oder eine zwingende Voraussetzung für den Marktzugang bilden (etwa: Zulassung von Medizinprodukten nach dem Medizinproduktegesetz).
EU-Konformitätsbewertung
Eine besondere Bedeutung hat die Konformitätsbewertung z. B. durch Benannte Stellen bei der Bewertung von Produkten auf ihre Übereinstimmung mit den Anforderungen einer EU-Richtlinie. Richtlinie 2001/95/EG über die allgemeine Produktsicherheit für den Europäischen Binnenmarkt legt für zahlreiche Produkte Mindestanforderungen an die Sicherheit fest, die vom Hersteller erfüllt werden müssen.
Durch ein „Konformitätsbewertungsverfahren“ muss der Hersteller nachweisen, dass er die in der Richtlinie oder den Richtlinien enthaltenen grundlegenden Sicherheitsanforderungen eingehalten hat. Das Konformitätsbewertungsverfahren muss vom Hersteller für jedes Produkt vor dem erstmaligen Inverkehrbringen durchgeführt werden. Am Ende des Konformitätsbewertungsverfahrens stellt der Hersteller eine EU-Konformitätserklärung für sein Produkt aus, in der er erklärt, dass das Produkt zu den Anforderungen der entsprechenden Richtlinie(n) konform ist. Am Produkt bringt der Hersteller dann die CE-Kennzeichnung an, falls die angewandte Richtlinie dies vorsieht.
Nur im Sektor "Medizinprodukte" besteht die Besonderheit, dass im Rahmen der Konformitätsbewertung nicht nur die Produktsicherheit nachgewiesen werden muss, sondern zusätzlich auch die medizinisch-technische Leistungsfähigkeit von Medizinprodukten, so wie sie vom Hersteller in der Produktkennzeichnung einschließlich der Werbung als medizinische Indikation ausgelobt ist. Das entsprechende Nachweisverfahren nennt sich klinische Bewertung. Erst der (je nach der Produktklasse) extern durch Benannte Stellen zertifizierte Nachweis der Produktsicherheit und der Leistungsfähigkeit berechtigt Hersteller von Medizinprodukten zur Anbringung der CE-Kennzeichnung.
In den Anhängen der Richtlinien werden verschiedene Module für die Durchführung eines Konformitätsbewertungsverfahrens genannt. Welche Module gewählt werden können, hängt von der Klassifizierung des Produktes ab. Für Produkte mit höherem Risiko ist die Einbeziehung einer Benannten Stelle bei der Durchführung des Konformitätsbewertungsverfahrens obligatorisch.
Module zum Konformitätsnachweis
In jeder einzelnen Harmonisierungsrichtlinie (etwa Druckgeräterichtlinie 2014/68/EU, Maschinenrichtlinie 2006/42/EG, ATEX Richtlinie 2014/34/EU, Medizinprodukte-Richtlinie 93/42/EWG) wird das anzuwendende Konformitätsbewertungsverfahren durch Angabe von Modulen oder Modulkombinationen beschrieben, um die Konformität mit den jeweils auf das Produkt zutreffenden Grundlegenden Anforderungen nachzuweisen. Mögliche Module oder Modulkombinationen sind (nicht vollständige Auflistung):
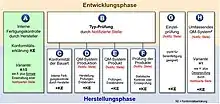
- Modul A
- Interne Fertigungskontrolle und Konformitätsnachweis durch den Hersteller (das ist der meistverwendete Konformitätnachweis)
- Modul B
- Variante 1: EU-Baumusterprüfung (Feststellung der Übereinstimmung des Baumuster des Produktes mit den grundlegenden Anforderungen der Richtlinie(n) z. B. auf der Basis der einschlägigen harmonisierten Normen, oder anderer relevanten Normen durch Benannte Stelle)
- Variante 2: Entwurfsprüfung (Feststellung der Übereinstimmung der technischen Dokumentation des Produktes mit den grundlegenden Anforderungen der Richtlinie(n) durch Benannte Stelle)
Modul B ist immer in Kombination mit Modul C, D, E, oder F anzuwenden:
- Modul C
- Konformität mit der Bauart (Der Hersteller erklärt die Konformität der Serienprodukte mit dem geprüften Baumuster auf der Basis seiner internen Fertigungskontrolle)
- Modul D
- Qualitätssicherung bezogen auf den Produktionsprozess (Darlegung der Qualitätssicherungsmaßnahmen vor, während und nach der Produktion einschließlich deren Häufigkeit; Audit durch Benannte Stelle)
- Modul E
- Qualitätssicherung bezogen auf das Produkt (Darlegung der Qualitätssicherungsmaßnahmen nach der Produktion einschließlich deren Häufigkeit (Endabnahme und Prüfung); Audit durch Benannte Stelle)
- Modul F
- Prüfung der Produkte (Prüfung der Produkte auf Übereinstimmung mit dem Baumuster entweder durch statistische Kontrollen oder Prüfung jedes einzelnen Produkts durch die Benannte Stelle)
- Modul G
- Einzelprüfung (durch Benannte Stelle; nur anwendbar auf Produkte, die nicht in Serie produziert werden)
- Modul H
- Umfassende Qualitätssicherung (vorzugsweise anwendbar auf Produkte, die in Serie produziert werden; kann in einigen Richtlinien alternativ zu Modul B verwendet werden; Audit durch Benannte Stelle)
- Modul H1
- Umfassende Qualitätssicherung (einschließlich Prüfung der Konformität des Entwurfs nebst Ausstellung einer "EG-Entwurfsprüfbescheinigung"; Audit und Prüfung durch Benannte Stelle)
Bezüglich der verschiedenen Verfahren der Bewertung (Zertifizierung) von Qualitätssicherungssystemen hat der Hersteller die Wahl zwischen den folgenden Qualitätsmodulen:
- Modul D (Qualitätssicherung der Produktion – Herstellung, Endabnahme und Prüfung):
Begutachtung und Bewertung durch die Benannte Stelle. Bei Zulassung des Qualitätssicherungssystems Ausstellung der EU-Modul-D-Bescheinigung. Das Qualitätssicherungssystem bezieht sich immer auf eine bestimmte Ausrüstung und setzt eine gültige Modul-B-Bescheinigung für die betreffende Ausrüstung voraus. Nur in Verbindung mit beiden Bescheinigungen ist der Hersteller oder sein Bevollmächtigter berechtigt, das Konformitätskennzeichen anzubringen.
- Modul E (Qualitätssicherung des Produkts – Endabnahme und Prüfung):
Die Zulassung des Qualitätssicherungssystems bezieht sich immer auf eine bestimmte Ausrüstung und setzt eine gültige Modul-B-Bescheinigung für die betreffende Ausrüstung voraus. Nur in Verbindung mit beiden Bescheinigungen ist der Hersteller oder sein Bevollmächtigter berechtigt, das Konformitätskennzeichen anzubringen.
Je höher das Gefahrenpotential eines Produktes ist, umso mehr Prüfungsumfang muss auf eine „Benannte Stelle“ übertragen werden. Diese wird durch eine vierstellige Kennziffer hinter der CE-Kennzeichnung angegeben. Die Konformitätsbewertung für Produkte mit einem sehr geringen Gefährdungspotenzial kann der Hersteller ohne Einschaltung einer Benannten Stelle selbst durchführen.
In jedem Fall – also auch bei Einschaltung einer Drittstelle – muss eine EU-Konformitätserklärung (in der Regel) durch den Hersteller ausgestellt werden. Dies unterstreicht dessen alleinige Verantwortung (= Haftung) für das Produkt.
Bei der Konformitätsbewertung müssen die Sicherheitsanforderungen der EU-Richtlinien eingehalten werden. Diese sind meistens recht allgemein gefasst, so dass konkrete technische Anforderungen aus Regelwerken abgeleitet werden müssen, die die allgemein anerkannten Regeln der Technik widerspiegeln. Dies können deutsche Normen, europäische Normen, Normen eines Mitgliedstaates der EU oder Normen von Verbänden sein. Im europäischen Binnenmarkt ist der Nachweis der Konformität von Erzeugnissen und Dienstleistungen mit europäischen gesetzlichen Anforderungen und mit Europäischen Normen ein Ordnungs- und Wettbewerbsinstrument von erheblicher Bedeutung.
Die Europäische Kommission hat ihre Vorstellungen hierzu in dem „Globalen Konzept für Zertifizierung und Prüfwesen in Europa“ niedergelegt. Sie will dadurch der Konformitätsbewertung einheitliche Maßstäbe geben, damit Erzeugnisse im Interesse eines freien Warenverkehrs nicht mehr mehrfach nationalen Prüfungen und Zertifizierungen unterzogen werden müssen. Die Konformitätsbewertung erfolgt im Anwendungsbereich der Richtlinien nach dem Neuen Konzept (oder Neuer Konzeption).
Um das Ziel eines freien Waren- und Handelsverkehrs und der Vereinheitlichung der Prüf- und Verwaltungsverfahren zu verwirklichen, beschloss der Rat 1990 und 1993 über die in den technischen Harmonisierungsrichtlinien zu verwendenden Module; seit 2008 ersetzt durch den "Beschluss 768/2008/EG des Europäischen Parlaments und des Rates über einen gemeinsamen Rechtsrahmen für die Vermarktung von Produkten und zur Aufhebung des Beschlusses 93/465/EWG des Rates" vom 9. Juli 2008. Diese Anpassung ist Teil des sogenannten "New legislative Framework" (ABl. L 218/82 vom 13. August 2008).
Literatur
- BVMed-Informationsreihe "Medizinprodukterecht": "Konformitätsbewertungsverfahren für Medizinprodukte"; www.bvmed.de.
- Günther Beer: Konformitätsbewertung – Begriffe und allgemeine Grundlagen in DIN-Mitteilungen, Oktober 2005, Beuth Verlag
- DIN EN ISO 17000: Konformitätsbewertung – Begriffe und allgemeine Grundlagen
- Röhl, Hans Christian / Schreiber, Yvonne: Konformitätsbewertung in Deutschland, 2006
- Klaus-Peter Schulz: Stichwörter zur Europäischen Normung, Beuth, 2002, ISBN 3410152695