Hypoplastisches Linksherz-Syndrom
Beim hypoplastischen Linksherz-Syndrom (HLHS), auch Linksherzhypoplasie-Syndrom genannt (hypoplastisch = zu klein, unterentwickelt), handelt es sich um mehrere miteinander vergesellschaftet auftretende Fehlbildungen des Herzens und der angeschlossenen Hauptschlagader (Aorta). Das hypoplastische Linksherz ist durch eine vollständige Ductusabhängigkeit (also den Blutdurchfluss durch eine kleine Gefäßverbindung, den Ductus arteriosus Botalli) charakterisiert. Ursache dafür sind:
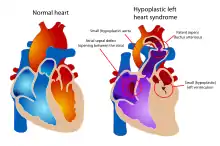
- eine hochgradige Aortenklappenstenose bzw. Aortenklappenatresie (Verengung bzw. Fehlen/Verschluss einer Herzklappe zwischen Aorta und linker Herzkammer = Ventrikel)
- und/oder eine Mitralklappenstenose bzw. Mitralklappenatresie (Verengung oder Fehlen/Verschluss der Klappe zwischen linkem Vorhof und linker Hauptkammer)
- mit hochgradiger Hypoplasie (= Unterentwicklung) der Aorta ascendens (dem aufsteigenden Teil der großen Körperschlagader, aus der die Koronararterien entspringen) (2–4 mm, normal 10–12 mm) bei Typ I
- und bei Typ II (anderes Erscheinungsbild des Herzfehlers in unterschiedlicher Ausprägung) mit normalem Durchmesser der Aorta ascendens
- und sehr kleinem (hypoplastischem) oder fehlendem linken Ventrikel (der sich aufgrund der Mitralklappenfehlbildung erst gar nicht entwickeln kann)
- und oft gleichzeitig vorliegendem hypoplastischen linken Vorhof = Atrium
| Klassifikation nach ICD-10 | |
|---|---|
| Q23.4 | Hypoplastisches Linksherzsyndrom |
| ICD-10 online (WHO-Version 2019) | |
Auch eine Endokardfibrose (Verdickung der Herzwand ohne funktionellen Nutzen) des linken Ventrikels und Vorhofes kann regelhaft vorkommen. Meist ist das Ventrikelseptum (Herzscheidewand auf Kammerebene) intakt, während ein offenes Foramen ovale (= Öffnung zwischen dem rechten und linken Herzvorhof, die auf Grund ihres Aussehens Foramen ovale (= „ovales Loch“) genannt wird) oder ein echter Vorhofseptumdefekt (ASD) den Abstrom des pulmonal-venösen (von der Lungenvene fließenden) Blutes aus dem linken Vorhof in den rechten Vorhof ermöglicht. In bis zu 20 % der Fälle besteht eine präduktale Aortenisthmusstenose (= Enge der Aorta vor der Einmündung des Ductus arteriosus). Die rechten Herzstrukturen sind meistens kompensatorisch vergrößert (Vergrößerung/Hypertrophie des rechten Vorhofes und Ventrikels).
Genetik
Ursächlich kommen auch angeborene Syndrome oder Mutationen infrage. Mutationen in folgenden Genen wurden beschrieben:[1] GJA1 (6q22.31), HAND1 (5q33.2)[2] und NKX2-5 (5q35.1)[3]
Körperliche Vorgänge/Pathophysiologie
Im Gegensatz zum regulären Blutstrom eines regelrecht entwickelten Herzens fließt beim HLHS zunächst das Blut der Lungenvenen über den linken Vorhof. Die bestehende Vorhoflücke (Foramen ovale), die das Überleben des Kindes sichert, lässt zu, dass sich das Blut über den rechten Vorhof mit nicht sauerstoffgesättigtem Blut vermischt. Man nennt dies medizinisch Links-rechts-Shunt. Weiter fließt dann vom rechten Ventrikel das Mischblut in die Pulmonalarterie und weiter über den Ductus arteriosus Botalli wieder in die Aorta descendens (absteigender Teil der Aorta, weiter geteilt in die Brust-Aorta und in die Bauch-Aorta). Zur gleichen Zeit fließt über den offenen Ductus arteriosus entgegen der normalen Strömungsrichtung Blut in die (unterentwickelte) Aorta ascendens (Teil der Aorta, aus der die Koronararterien entspringen) und damit in die Koronararterien. Diesen Vorgang nennt man „retrograde Perfusion“.
Kinder mit diesem Krankheitsbild werden auch als „Blue Baby“ bezeichnet.
Behandlung
Bei sichergestellter Diagnose eines hypoplastischen Linksherz-Syndroms gibt es heute verschiedene Ansätze zur Behandlung:
- das Kind wird ohne medizinische und operative Versorgung dem sog. „natürlichen Verlauf“ überlassen. Das heißt, es verstirbt in der Regel innerhalb weniger Tage oder Stunden, nur in Ausnahmefällen in wenigen Wochen.
- die 3-stufige chirurgische Palliation.
- klassische Norwood-Operation, auch Norwood-Procedure genannt
- Diese Operationstechnik umschließt zunächst eine erste lebenserhaltende Operation, die Norwood-Stage1-Operation, wobei zunächst die unterentwickelte Aorta mittels eines Kunststoffflickens erweitert wird. Dazu wird bei dieser Operation gleichzeitig der rechte Ventrikel mit der Aorta verbunden und ein Shunt (= Kunststoffröhrchen) für die Lungendurchblutung angelegt. Diese Operation erfolgt unter Einsatz der Herz-Lungen-Maschine und im Zustand des Herzstillstandes.
- Die Norwood-Stage2-Operation, auch Glenn-Anastomose genannt (bzw. „Hemi-Fontan“), bewirkt eine Verbindung der oberen Hohlvene mit der Arteria pulmonalis. Das Kind erhält durch diese Operation eine sicherere Lebenssituation, da der Shunt der ersten Operation nun entfernt werden kann. Eine Behandlung mit gerinnungshemmenden Medikamenten – wie Cumarinen – ist in den meisten Fällen nicht mehr nötig.
- Norwood-Stage3-Operation = kompletter Fontan (TCPC): bei diesem Operationsschritt erfolgt ein Anschluss nun auch der unteren Hohlvene an die Pulmonalarterie, sodass eine komplette Kreislauftrennung erzielt wird.
- alternativ Giessen-Procedure (Hybrid-OP)
- Hierbei handelt es sich um einen sogenannten Hybrideingriff durch Kinderherzchirurgen und Kinderkardiologen. Zunächst erfolgt die katheterinterventionelle Einbringung eines Stents in den Ductus arteriosus zur Sicherstellung der Perfusion des Körperkreislaufs. Nachfolgend wird eine beidseitige Bändelung der Pulmonalarterien zur Drosselung des pulmonalen Blutflusses chirurgisch angelegt. Die Operation kann zunächst ohne Herz-Lungen-Maschine stattfinden.[5]
- Im Verlauf Norwood-Stage2-Operation mit Rekonstruktion der unterentwickelten Aorta (s. o.).
- klassische Norwood-Operation, auch Norwood-Procedure genannt
- als seltene letzte Möglichkeit: eine Herztransplantation
Prognose
Obwohl das HLHS ein sicherlich schwerwiegender Herzfehlbildungskomplex ist, zeigen die Erfahrungen der letzten Jahre, dass in den spezialisierten Herzzentren die Behandlung dieses Herzfehlers mittlerweile gute Behandlungsaussichten bietet. Die Erfahrungen aus Amerika zeigen, dass es bereits Erwachsene gibt, die einstmals mit HLHS geboren wurden und die durch Norwood-Procedure eine gute bis sehr gute Lebensqualität erhielten. Mittlerweile gilt das HLHS in Amerika nicht mehr zwingend als Indikation zur Abtreibung. Im Gegenteil gibt es sogar eine Behandlungspflicht für Kinder mit dieser Fehlbildung, da bei adäquater Behandlung diesen Kindern zu einem normalen Leben mit guter Lebensqualität zu verhelfen ist.
Die unterschiedlichen Betrachtungsweisen zwischen Deutschland und Amerika rühren auch daher, dass z. T. die Zahlen aus den Anfängen dieser Operationstechnik in Deutschland noch immer mit in die Sterblichkeitsquoten einfließen, welche dadurch ein verfälschtes Bild der heutigen Realität zeigen. Durch den Einsatz routinierter Kinder-Herzchirurgen, verbesserte Operationstechniken und verfeinerte Untersuchungsmethoden hat ein großer Teil der heute operierten Kinder wesentlich bessere Langzeitprognosen als noch zu Beginn dieser Operationstechnik in den 1980er Jahren. Als letzte Option verbleibt auch noch die Möglichkeit einer Herztransplantation, die mittlerweile schon mit guten Erfolgen durchgeführt werden kann. Für das HLHS gibt es also verschiedene Behandlungsansätze, die dem Kind die Möglichkeit zu einem erfüllten Leben mit guter Lebensqualität eröffnen.
Zurück zu Herzfehlerbeschreibungen
Literatur
- J. A. Connor, R. Thiagarajan: Hypoplastic left heart syndrome. In: Orphanet Journal of Rare Diseases. Band 2, 2007, S. 23, ISSN 1750-1172. doi:10.1186/1750-1172-2-23. PMID 17498282. PMC 1877799 (freier Volltext). (Review).
- S2k-Leitlinie Hypoplastisches Linksherzsyndrom (HLHS) der Deutschen Gesellschaft für Pädiatrische Kardiologie (DGPK). In: AWMF online (Stand 2013)
- Elterninformationsbroschüre vom Bundesverband Herzkranker Kinder BVHK e. V.:Leitfaden HLHS und das univentrikuläre Herz Stand 03/2013
Weblinks
Einzelnachweise
- D. R. Fulton: "Hypoplastic left heart syndrome", 2021, Up To Date
- Hypoplastic left heart syndrome 1. In: Online Mendelian Inheritance in Man. (englisch)
- Hypoplastic left heart syndrome 2. In: Online Mendelian Inheritance in Man. (englisch)
- J. A. Feinstein, D. W. Benson, A. M. Dubin et al.: Hypoplastic left heart syndrome: current considerations and expectations. In: Journal of the American College of Cardiology. Band 59, Nummer 1 Suppl, Januar 2012, S. S1–42, doi:10.1016/j.jacc.2011.09.022, PMID 22192720, PMC 6110391 (freier Volltext) (Review).
- Hakan Akintürk, Ina Michel-Behnke, Klaus Valeske, Matthias Mueller, Josef Thul: Hybrid Transcatheter–Surgical Palliation. In: Pediatric Cardiology. Band 28, Nr. 2, 1. April 2007, ISSN 1432-1971, S. 79–87, doi:10.1007/s00246-006-1444-7.