Ghosez-Cyclisierung
Die Ghosez-Cyclisierung ist eine Namensreaktion in der Organischen Chemie, welche 1988 erstmals von dem belgischen Chemiker Léon Ghosez (* 1934) vorgestellt und nach ihm benannt wurde.[1]
Übersichtsreaktion
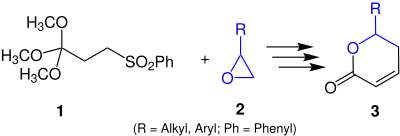
Bei dieser Reaktion wird Phenylsulfonyl-Orthobuttersäuretrimethylester 1 mittels eines Epoxids 2 zu einem δ-Lacton 3 cyclisiert.[1]
Reaktionsmechanismus
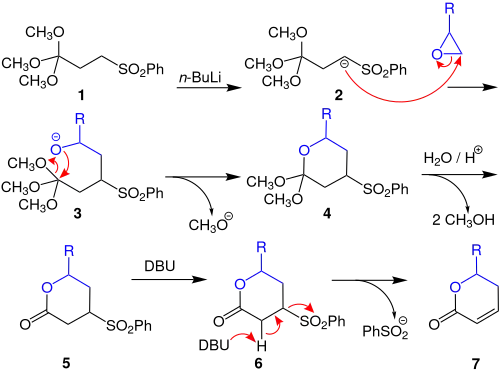
Zunächst wird der Orthoester 1 mit Butyllithium (n-BuLi) deprotoniert, sodass eine negative Ladung am nächsten Kohlenstoffatom zur Phenylsulfonylgruppe entsteht 2 und dies das Epoxid nucleophil angreifen kann. Anschließend kann das nun negativ geladene Sauerstoffatom des vormaligen Epoxids das zentrale Kohlenstoff des Orthoesters nucleophil Angreifen 3 wodurch sich ein Methylalkoholat abspalten und abgehen kann. Durch Protonierung wird im folgenden Schritt 4 zweimal Methanol abgespaltet. Dadurch entsteht eine Vorstufe 5 des gewünschten Lactons. Durch Zugabe von Diazabicycloundecen (DBU) kann diese Vorstufe deprotoniert werden und die Phenylsulfonylgruppe wird abgespalten 6, wodurch das Endprodukt 7 entsteht.[1]
Anwendung
Die Ghosez-Cyclisierung findet Verwendung für die C-C-Verknüpfung bei der Synthese komplexer Moleküle, beispielsweise bei der Totalsynthese von Swinholid A, ein mariner Naturstoff mit fungizider und antineoplastischer Wirkung.[2]
Einzelnachweise
- Zerong Wang: Ghosez Cyclization: (Ghosez Lactonization). In: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Inc., Hoboken, NJ, USA 2010, ISBN 978-0-470-63885-9, doi:10.1002/9780470638859.conrr268.
- K. C. Nicolaou, Dionisios Vourloumis, Nicolas Winssinger, Phil S. Baran: Der Stand der Totalsynthese zu Beginn des 21. Jahrhunderts. In: Angewandte Chemie. Band 112, Nr. 1, 3. Januar 2000, S. 46, doi:10.1002/(SICI)1521-3757(20000103)112:1<46::AID-ANGE46>3.0.CO;2-P.