Gaius villosus
Gaius villosus ist eine im westaustralischen Weizengürtel verbreitete Webspinne aus der Unterordnung Vogelspinnenartige. Ihre monotypische Gattung Gaius gehört zur Familie Idiopidae. Ein bis 2017 verwendetes Synonym von Gaius villosus ist Anidiops villosus, die übrigen Arten von Anidiops stehen heute in der Gattung Idiosoma.
| Gaius villosus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Gaius villosus (Museumsexemplar) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Gaius | ||||||||||||
| Rainbow, 1914 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Gaius villosus | ||||||||||||
| Rainbow, 1914 |
Gaius villosus gilt als eine der größten und am besten an semiaride Lebensräume angepassten Arten unter den in Australien zusammenfassend als „Falltürspinnen“ bezeichneten Spinnen. Im Unterschied zu vielen ihrer Verwandten hat die Art ein großes Verbreitungsgebiet und ist stellenweise häufig.
Beschreibung
Gattung Gaius
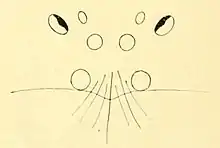
Die Arten der Gattung Gaius unterscheiden sich von allen anderen Gattungen der Familie Idiopidae durch die Kombination der folgenden Merkmale:
- die trapezförmige Anordnung der vorderen Ocellen, die hinteren seitlichen Ocellen stehen vor den mittleren und bilden mit ihnen einen ausgeprägten Bogen;
- einen stark ausgeprägten distalen tibialen Sporn an den Pedipalpen männlicher Spinnen;
- die dichte Behaarung von Körper und Beinen.[1]
Die meisten Arten der Gattung Gaius, einige in Sammlungen belegte Arten wurden noch nicht beschrieben, verfügen über einen weiteren massiven tibialen Sporn. Sie erreichen eine beachtliche Größe und gehören, abgesehen von den Arten der Familie Theraphosidae, zu den größten australischen Vogelspinnenartigen.[1][2]
Da für adulte weibliche und für juvenile Exemplare keine hinreichenden morphologischen Merkmale zur Bestimmung von Gattung und Art existieren, wird heute zur Bestimmung eine molekularbiologische Untersuchung herangezogen.[1]
Gaius ist nahe mit der Gattung Eucyrtops Pocock, 1897 verwandt. Von dieser Gattung unterscheidet sich Gaius durch seine Größe, die stärkere Behaarung von Körper und Beinen und den distalen tibialen Sporn.[1]
Gaius villosus
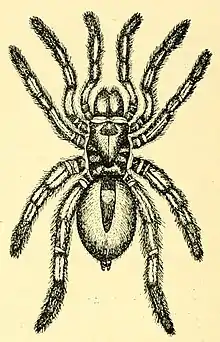
Mit einer Körperlänge, einschließlich der Cheliceren, von bis zu fünf Zentimeter ist Gaius villosus eine der größten australischen Spinnen aus der Verwandtschaft der Falltürspinnen. Ihre Größe wird als evolutionäre Anpassung an ihre semiariden Lebensräume verstanden, da sie eine Verringerung der relativen Körperoberfläche und des Wasserverlustes bedeutet.[3][4]
Die Art zeichnet sich durch ihre sehr starke Behaarung aus, Ihre Farbe ist dunkelbraun, fast schwarz. Aufgrund ihrer Größe, ihren kräftigen Beinen und Pedipalpen sowie den massiven Cheliceren ist sie leicht als Vogelspinnenartige zu identifizieren. Im Feld ist die Art an den charakteristischen Eigenschaften ihrer Wohnröhren zu erkennen.[5]
Verbreitung
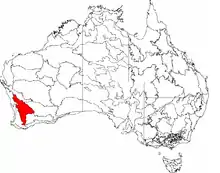
Die Typlokalität von Gaius villosus ist das Minnivale Nature Reserve im westaustralischen Shire of Dowerin. Die Typlokalität befindet sich in der Bioregion Avon Wheatbelt, die ihrerseits in der vom WWF als stark gefährdet angesehenen WWF-Ökoregion Southwest Australia Savannas liegt.[6][7]
Das Verbreitungsgebiet der Gattung Gaius erstreckt sich in Western Australia vom südlichen Weizengürtel und der westlichen Nullarbor-Ebene nach Norden bis nach Pilbara und zur Kleinen Sandwüste. Dort herrscht ein semiarides Klima mit trockenen Sommern und winterlichen Regenfällen vor. Die Lebensräume von Gaius villosus werden häufig von Mulga oder Dickichten aus anderen Arten von Akazien geprägt und gehören zu einem in Australien als Wodjil bezeichneten Landschaftstyp. Die Art kommt jedoch auch in Habitaten vor, in denen Kasuarinengewächse oder Eukalypten dominieren. Gaius villosus bevorzugt lehmige Böden.[1][4][8]
Lebensweise
Wohnröhren
Die Arten der Gattung Gaius leben als Lauerjäger in bis zu 70 Zentimeter tiefen vertikalen Wohnröhren im Bereich der Streuschicht unter Bäumen oder Büschen, in denen stets eine ausreichende Luftfeuchtigkeit und gemäßigte Temperaturen herrschen. Die Wohnröhren sind mit einem aus Spinnenseide und kleinen Zweigen gefertigten und mit eingesponnenen Erdbrocken getarnten Klappdeckel verschlossen. Die Wohnröhre ist stets bis wenige Zentimeter unterhalb der Eingangsöffnung mit Spinnenseide ausgekleidet. Der obere Bereich dieser Auskleidung ist mit wenigen Spinnfäden nur lose an der Wand der Wohnröhre befestigt. Die Spinnen lösen nach der Nahrungsaufnahme häufig die Umhüllung von der Wand, verbringen unverdauliche Nahrungsreste in den Zwischenraum, und befestigen die Hülle wieder. Bei Gefahr durch einen Eindringling löst die Spinne den „Strumpf“ am oberen Ende von der Wand und zieht ihn nach unten, so dass sich von oben das Bild einer am Boden mit Nahrungsresten bedeckten leeren Wohnröhre bietet.[9][10][11][2]
Die Spinnen legen um den Eingang der Wohnröhre herum einen Fächer aus Zweigen mit dem Eingang im Zentrum an. Die Zweige sind mit Spinnfäden am Rand der Wohnröhre befestigt und haben vorrangig eine Funktion als Signalgeber, deren Berührung durch eine potentielle Beute von den Spinnen mit den Tarsen wahrgenommen wird. Die lauernde Spinne verlässt ihre Wohnröhre wenn sie eine Beute wahrnimmt einige Zentimeter weit. Die Zweige vergrößern somit den Jagdbereich im Vergleich zu anderen Falltürspinnen, die nur solche Beute ergreifen, die ohne Verlassen der Wohnröhre überwältigt werden kann. Die ringförmige Anordnung von Steinen um den Eingang der Wohnröhren einer namibischen Art der Gattung Ariadna (Fischernetzspinnen) dient demselben Zweck. Sie vergrößert den Wahrnehmungsbereich und gilt als eine Form des Werkzeuggebrauchs.[12] Darüber hinaus sammeln sich an den Zweigen Tau- und Regentropfen, die die Wasserversorgung der Spinne verbessern.[10][13][11][2]
Gaius villosus ist auf eine intakte Streuschicht mit entsprechendem Baumaterial und auf den Schatten der Vegetation angewiesen. Störungen wie das Entfernen von Zweigen oder gar des Deckels der Wohnröhre durch stöbernde Vögel und andere Tiere können von adulten Spinnen verkraftet werden, wenn die Wohnröhre selbst unzerstört bleibt. In diesen Fällen wird der Fächer aus Zweigen neu geordnet und der Deckel wieder angebracht, gelegentlich auch falsch herum. Jungspinnen können eine neue Wohnröhre graben, wenn die alte zerstört wird. Beim ersten Bau gräbt die junge Spinne nur so tief, dass sie sich vollständig in die Wohnröhre zurückziehen kann. Anschließend wird der Fächer aus Zweigen angelegt und zum Schluss die Falltür gebaut. Die Reihenfolge ist bei späteren Bauten verändert, die Falltür wird dann vor dem Fächer angelegt. Das wird auf die Notwendigkeit der raschen Nahrungsbeschaffung zurückgeführt, die für gerade aus der Wohnröhre der Mutter kommende Jungspinnen Priorität hat. Nach der ersten Nahrungsaufnahme tritt der Sicherheitsaspekt einer Falltür in den Vordergrund.[13][14][15]
Während des Heranwachsens werden die Wohnröhren der Falltürspinnen wiederholt in Durchmesser und Tiefe erweitert. Das geschieht bei anderen Arten während der Regenfälle im Herbst, wenn der Boden feucht ist und bearbeitet werden kann. Die gelöste Erde wird von den Spinnen ohne die Wohnröhre zu verlassen hinausgeschleudert, so dass sie einen Ring um den Eingang bildet. Gaius villosus gehört zu den wenigen Arten, die ihre Wohnröhre nach Sommergewittern erweitern. Da das Herausschleudern der Erde den Fächer aus Zweigen in seiner Funktion beeinträchtigen würde hat die Art eine eigene Strategie zur Entsorgung der Erde entwickelt. Knapp unterhalb des „Scharniers“ der Falltür gräbt sie seitwärts einen Tunnel, dessen Decke sie mit der ausgehobenen Erde formt. Von außen betrachtet erscheint dieser Tunnel wie ein von der Wohnröhre wegführender Wulst aus Erde. Auf diese Weise bleibt die Spinne bei der Entsorgung vor Fressfeinden weitgehend verborgen, nur in seltenen Fällen versuchen Vögel die Spinne im Tunnel zu erbeuten. Nach dem Erweitern der Wohnröhre verschließt die Spinne den Tunneleingang mit Erde und überzieht ihn wieder mit Spinnseide. Der ungenutzte Tunnel sinkt bei den nächsten Regenfällen in sich zusammen.[13]
Die Durchmesser der Deckel sind ein Indiz für das Alter der Spinne, die eine Wohnröhre bewohnt. Das Heranwachsen von Gaius villosus zum adulten Exemplar dauert fünf Jahre, die Geschlechtsreife tritt mit sechs Jahren ein. Deckeldurchmesser von vier und mehr Zentimeter und Röhrendurchmesser von mehr als 3,5 Zentimeter deuten auf ein geschlechtsreifes Weibchen hin. Bei Deckeldurchmessern von etwa fünf Zentimeter, die während des Sommers auf 4,5 Zentimeter zurückgehen können, kommt es zu keiner weiteren Zunahme. Das tatsächliche Alter einer Spinne kann im weiteren Verlauf mithilfe der Aufzeichnungen über eine markierte Wohnröhre belegt werden, da die weiblichen Spinnen stets in ihrer Wohnröhre verbleiben und die Wohnröhren nach dem Tod einer Bewohnerin nicht neu belegt werden.[16]
Aggregationen
Gaius villosus bildet aufgrund der geringen Mobilität der jungen Spinnen Aggregationen mit zahlreichen Wohnröhren von Spinnen unterschiedlichen Alters. Die Wohnröhren der jungen Spinnen befinden sich meist unter demselben Baum oder Strauch wie die ihres Muttertieres, wodurch unter einem einzigen Baum Dutzende Wohnröhren liegen können. Eine hinreichende Anzahl von Beutetieren vorausgesetzt kann die Dichte so groß sein, dass die Fächer aus Zweigen um die Eingänge der Wohnröhren fast aneinander stoßen. Solche dicht besiedelten Bereiche oder Aggregationen sind voneinander durch Bereiche ohne Streuschicht oder aus anderen Gründen ungeeigneten Boden getrennt. Abhängig vom Alter des Baumes oder Strauchs, unter dem das Nest eines Muttertieres liegt, kann die Streuschicht so dicht sein, dass Jungspinnen dort keine Wohnröhre graben können. In diesen Fällen wandern sie bis zum Auffinden eines geeigneten Ortes umher und sind verstärkt durch Prädatoren bedroht. Die eigentlich störende Aktivität stöbernder Vögel und Kleinsäugetiere kann dazu beitragen, dass eine für Jungspinnen zu dichte Streuschicht aufgelockert und teilweise entfernt wird, so dass wieder geeignete Bereiche für deren Ansiedlung frei werden.[17][18]
Fortpflanzung
Die Spinnen werden im Frühherbst geschlechtsreif. Beim Einsetzen der Regensaison, örtlich und jährlich unterschiedlich zwischen Ende März und Ende Juni, verlassen die männlichen Spinnen ihre Wohnröhren und begeben sich auf die Suche nach geschlechtsreifen Weibchen. Nach der Paarung mit einem oder mehreren Weibchen in deren Wohnröhren sterben die Männchen. Für weibliche Spinnen sind Lebensspannen von mehr als vierzig Jahren belegt, ein Alter von mehreren Jahrzehnten ist nicht ungewöhnlich. Die mit der Langlebigkeit verbundene Fähigkeit, mehrfach Nachwuchs aufzuziehen, trägt wesentlich zum Erhalt der Art in ihren für Spinnen eher ungünstigen Lebensräumen bei.[4][19][20]
Im Anschluss an die Paarung ziehen die Weibchen sich in ihre Wohnröhren zurück und verschließen sie mit einem Pfropf aus Erde. Die Eiablage erfolgt während des Frühlings, die Eier werden von der Mutter in einen scheibenförmigen Kokon eingesponnen, den sie mit mehreren Spinnfäden an der Wand der Wohnröhre befestigt. Die Brut schlüpft im Hochsommer und hat eine Länge des Carapax von etwa drei Millimeter. Für ein besonders großes Weibchen ist eine Brut mit 42 Nachkommen belegt, die durchschnittliche Zahl liegt niedriger. Die Wohnröhre bleibt bis in den Herbst, ein volles Jahr nach der Paarung, verschlossen, um die Eier und die Brut vor der Sommerhitze zu schützen. Wenn die Paarung sehr zeitig erfolgt, und die herbstlichen Regenfälle des folgenden Jahres spät einsetzen, können die Wohnröhren deutlich länger als ein Jahr verschlossen bleiben.[21][5][20]
Im Frühherbst verlassen die jungen Spinnen die Wohnröhre ihrer Mutter und graben in deren Nähe eigene Wohnröhren, in denen sie zu adulten Tieren heranwachsen. Dabei halten auch sie eine Sommerruhe in verschlossenen Wohnröhren ein, die jedoch deutlich kürzer ist. Jungspinnen, die die Wohnröhre der Mutter verlassen haben und noch keine eigene gegraben haben, sind besonders durch Prädatoren wie Vögel, Frösche, Eidechsen und andere Gliederfüßer gefährdet. Einige junge Spinnen, die ihre Wohnröhre zu nahe an den Wohnröhren älterer Spinnen graben, werden von diesen rasch getötet. Darüber hinaus ist Kannibalismus unter den jungen Spinnen eine häufige Erscheinung. Er wird dadurch begünstigt, dass die Jungspinnen ihre Wohnröhren in der Nähe der Wohnröhre des Muttertieres anlegen. Häufig überlappen aufgrund der hohen Populationsdichte die um die Wohnröhren angelegten Ringe aus Zweigen einander, in der Folge kommt es zu tödlichen Begegnungen der Nachbarn.[21][2]
Die meisten Jungspinnen, die eine Wohnröhre graben können, überleben mindestens bis zum Sommer, in dem es witterungsbedingt zu einer hohen Sterblichkeit kommt. Dazu tragen die schlechtere Temperatur- und Feuchtigkeitsregulation in den kleineren Wohnröhren junger Spinnen, ihr ungünstigeres Verhältnis von Körpermasse zu Körperoberfläche und das während der Trockenheit verminderte Nahrungsangebot bei. Bei Spinnen, die bereits zwei Sommer überstanden haben, ist es wahrscheinlich dass sie mindestens vier Jahre alt werden. Der Anteil der Jungspinnen, die bis zur Geschlechtsreife heranwachsen, wird auf maximal 3,75 Prozent geschätzt.[4][21]
Bei geschlechtsreifen Weibchen folgt auf ein Jahr mit Nachwuchs mindestens ein Jahr ohne Brut, und sie pflanzen sich nicht in dem Jahr fort, in dem sie ausgewachsen sind. Adulte Weibchen ohne Brut versiegeln ihre Wohnröhren nicht, sondern bleiben aktiv.[4][19]
Interaktion mit anderen Tieren
Gaius villosus ist in den von ihm besiedelten Lebensräumen ein bedeutender Prädator. Aufgrund seiner Größe kann er auch kleine Wirbeltiere überwältigen, seine Hauptnahrung sind jedoch Termiten und Ameisen. Wahrscheinlich besteht ein Zusammenhang zwischen der Bevorzugung von Standorten unter Akazien für den Bau der Wohnröhren und dem Verhalten der bevorzugten Beute. An den Akazien parasitieren Schildläuse, die wiederum die wichtigste Beute der Ameisen sind. Daher bilden die Ameisen intensiv genutzte „Straßen“ von ihren Nestern zu den in der Nähe liegenden Akazien, während die Flächen zwischen den Bäumen oder Büschen kaum genutzt werden. Entsprechend bildet Gaius villosus unter Akazien dichte Ansiedlungen. Die Flächen zwischen den Akazien, die kaum Zweige für die Eingänge der Wohnröhren und nur wenig Nahrung bieten, werden auch von den Spinnen nicht besiedelt.[22]
Vor Fressfeinden sind adulte Exemplare aufgrund ihrer versteckten Lebensweise und der Ausstattung ihrer Wohnröhren mit Falltüren und dem einziehbaren „Strumpf“ aus Spinnenseide gut geschützt. Eine Ausnahme sind Skorpione der Art Isometroides vescus, die sich ausschließlich von Spinnen ernähren, die ihre Wohnröhren mit Falltüren verschließen. Ihnen kann auch Gaius villosus zum Opfer fallen, Konfrontationen können aber auch für den Skorpion tödlich enden. Mehrfach sind unversehrte Spinnen in ihrer Wohnröhre unterhalb des eingezogenen „Strumpfes“ vorgefunden worden, während sich ein eingedrungener Isometroides vescus oberhalb befand und die Beute nicht erreichen konnte.[23][24][25]
In älteren Wohnröhren lebt häufig eine große Zahl nicht näher bestimmter Milben, die sich von den Nahrungsresten der Spinnen ernähren und dadurch der Bildung von Schimmel vorbeugen. In seltenen Fällen wurden mit Milben verkrustete Spinnen beobachtet.[26]
Auch über Parasiten sind keine näheren Einzelheiten bekannt. In der Literatur ist ein Fund der leeren Puppenhülle einer parasitären Wespe genannt worden. Die älteste Spinne der Art Gaius villosus ist im Jahr 2017 im Alter von mindestens 43 Jahren wahrscheinlich einer Wegwespe zum Opfer gefallen.[27][28]
Buschbrände
Buschbrände sind in Australien häufig und waren bereits vor der Besiedlung des Kontinents durch Europäer ein bedeutender ökologischer Faktor. Für den Wodjil als typischen Lebensraum von Gaius villosus wird von durchschnittlich zwei natürlichen Buschfeuern in 100 Jahren ausgegangen, die nur in den trockenen Sommermonaten vorkommen. Die Vegetation aus Akazien ist teilweise zur Vermehrung auf Buschfeuer angewiesen, innerhalb von fünf Jahren hat sich die Vegetation einer Brandstelle erneuert oder erholt. Die adulten Spinnen und ihre Brut können Buschfeuer in ihren versiegelten Wohnröhren überleben, während heranwachsende Spinnen meist durch das Feuer sterben. Auch die wichtigsten Beutetiere, Termiten und Ameisen, überleben Buschfeuer in ihren Bauten und Nestern. Das Überleben der Brut mit den Muttertieren in deren Wohnröhren stellt jedoch nicht sicher, dass nach einem Buschfeuer rasch die Neubesiedelung des Lebensraums erfolgen kann.[29][15][30]
Nach einem Feuer bestehen wegen des Verlusts des Unterholzes und der Streuschicht schwierigere Lebensverhältnisse für die überlebenden Spinnen, so dass ein erheblicher Anteil der zunächst überlebenden Spinnen in den folgenden Monaten zugrunde geht. Die Art breitet sich in neue oder unbesetzte Lebensräume nur langsam über den Boden aus, und nach einem Feuer finden die Jungspinnen keinen für eine Ansiedlung geeigneten Lebensraum mehr vor. Damit ist Gaius villosus gegenüber solchen Arten im Nachteil, deren Populationen einem Feuer vollständig zum Opfer fallen, die aber einen neuen oder freigewordenen Lebensraum mithilfe von Flugfäden durch die Luft besiedeln können.[29][15][31]
Langzeitbeobachtung 1974 bis 2017
Bereits 1968 und 1969 hatte die Arachnologin Barbara York Main im Naturschutzgebiet North Bungulla Nature Reserve (31° 31′ 33,4″ S, 117° 35′ 28,9″ O) eine Untersuchung der Fauna der Vogelspinnenartigen durchgeführt und einige Wohnröhren der als langlebig bekannten Art Gaius villosus identifiziert und markiert. Das Naturschutzgebiet mit einer Fläche von 104 Hektar liegt im Shire of Tammin, im Weizengürtel des Bundesstaates Western Australia, etwa 15 Kilometer nordöstlich der Ortschaft Tammin auf einer Höhe von etwa 330 Meter über dem Meeresspiegel. Es stellt einen der wenigen Überreste der natürlichen Vegetation dar, die in der Region nach der großflächigen Anlage landwirtschaftlicher Nutzflächen zwischen 1920 und 1980 erhalten geblieben sind.[17][32][33]
Bei dem Naturschutzgebiet handelt es sich um einen für Gaius villosus typischen Lebensraum mit Bewuchs aus Mulga und Akaziendickicht. Das eigentliche Untersuchungsgebiet hat eine Fläche von 40 × 26 Meter. In seiner Nähe oder unmittelbar angrenzend befinden sich Termitenhügel der Gattung Drepanotermes und zwei große Nester der Ameisenart Iridomyrmex purpureus. Die Termiten und Ameisen sind eine wichtige Beute für Spinnen, aber auch für Laufhühnchen und Kurzschnabeligel, die bei der Suche nach ihnen die Streuschicht durchwühlen und die Spinnen stören können. Barbara York Main ist auf einer Farm in unmittelbarer Nachbarschaft aufgewachsen.[17][32][33]
Ab dem 16. März 1974 wurden im Untersuchungsgebiet die Wohnröhren von Gaius villosus mit nummerierten Markierungen versehen. Zunächst sollte nur die Lebensspanne der Spinnen durch das Markieren der Wohnröhren juveniler Exemplare und gelegentliche Kontrollen ermittelt werden. Im Laufe der Untersuchung gewannen die Forscher die Erkenntnis, dass das Untersuchungsgebiet ideale Voraussetzungen für eine umfangreichere demographische Studie bot. Bis Ende 1976 waren 64 Wohnröhren markiert. Im Herbst und Winter 1977 kamen 37 hinzu, von denen einige unentdeckten Spinnen aus den beiden Vorjahren gehörten. Bei der ersten Markierung und den sporadischen Kontrollen wurden die Durchmesser von Falltüren und Wohnröhren gemessen und der Zustand der Wohnröhren, insbesondere ob sie verschlossen waren, dokumentiert. Am 22. Juni 1975 wurde die Wohnröhre jener Spinne markiert, die Jahrzehnte später als Number 16 bekannt wurde.[17]
Während der ersten Jahre lieferte die Studie grundlegende Informationen zur Biologie von Gaius villosus. So wurden die Lebensgeschichten aller Spinnen und ihrer Nachkommen über mehrere Generationen dokumentiert, die Überlebenswahrscheinlichkeit auch in Bezug auf die Witterung in verschiedenen Jahren untersucht, das Reproduktionsverhalten weiblicher Spinnen in aufeinanderfolgenden Jahren beobachtet und die Ausbreitung der Nachkommen nach dem Verlassen der Wohnröhre der Mutter verfolgt. Obwohl Gaius villosus selbst weit verbreitet ist, sind die Ergebnisse der Untersuchung, insbesondere in Bezug auf die mangelnde Fähigkeit zur Besiedelung neuer Lebensräume, für zahlreiche andere seltene und im Bestand gefährdete Arten von Falltürspinnen bedeutsam. Viele dieser Arten haben nur sehr kleine Verbreitungsgebiete oder sind nur von einem Fundort bekannt, so dass vergleichsweise geringe Eingriffe in den Naturhaushalt die ganze Art vernichten können.[28]
Am 31. Oktober 2016 wurde die Wohnröhre von Number 16 leer und mit einer perforierten Falltür vorgefunden. Offenbar war Number 16 innerhalb der sechs Monate seit der letzten Kontrolle von einer parasitären Wegwespe getötet worden.[28]
Gefährdung und Schutz
Gaius villosus kommt innerhalb seines großen Verbreitungsgebiets stellenweise häufig vor. Die Art gilt nicht als gefährdet.[8]
Als eine wenig mobile und langlebige Art mit geringer Reproduktionsrate ist Gaius villosus stärker als andere Spinnen von Habitatveränderungen betroffen. Eine besondere Bedrohung stellen Buschfeuer dar, die eine Population stark beeinträchtigen können und nicht nur natürlich vorkommen, sondern im Rahmen der Forstwirtschaft gezielt und häufig eingesetzt werden.[3][15][30]
Das Beweiden von Flächen durch Huftiere führt zum Aufbrechen der obersten Bodenschicht, zu verstärkter Bodenerosion und möglicherweise zu geringerer Verfügbarkeit von potentieller Beute. Durch das Beweiden wird die Streuschicht zerstört, zudem kommt es zur Zerstörung der Eingänge oder der ganzen Wohnröhren. Auf Weideflächen kann Gaius villosus nicht überleben. Auf landwirtschaftlich genutzten Flächen wird die Art nur dort nachgewiesen, wo die Weidetiere keinen Zugang haben, beispielsweise an Baumstümpfen oder Felsen. Dadurch entstehen kleine voneinander isolierte Populationen, zwischen denen kein genetischer Austausch stattfindet und die auch keine Möglichkeit der Expansion haben. Wildkaninchen können beim Anlegen ihres Baus in einem dicht belegten Bereich mehrere Wohnröhren von Gaius villosus zerstören, was für ausgewachsene Spinnen den Tod bedeutet.[29][34]
Die mehr als 40 Jahre währende Langzeitbeobachtung einer Population von Gaius villosus gibt Anlass zu der Vermutung, dass Populationen nur mit mindestens 20 älteren weiblichen Spinnen („Matriarchinnen“) dauerhaft bestehen können. Darüber hinaus sind wahrscheinlich Verbindungen zu benachbarten Populationen erforderlich, mit denen in Zeiten schlechter Fortpflanzungsbedingungen ein Austausch stattfinden kann.[30]
Eine Möglichkeit zum Schutz von Falltürspinnen besteht darin, Flächen einzuzäunen und von der Beweidung und der Forstwirtschaft auszunehmen. Gesunde Populationen von Gaius villosus zeichnen sich durch die Anwesenheit ausgewachsener und heranwachsender Spinnen aus, während ausschließlich von adulten Exemplaren besiedelte Flächen auf mangelnde Reproduktion und Niedergang hindeuten.[29]
Systematik
Die monotypische Gattung Gaius Rainbow, 1914 umfasst neben der einzigen beschriebenen Art Gaius villosus Rainbow, 1914 mehrere noch unbeschriebene Arten.[1]
Die Gattung Gaius bildet mit weiteren vier Gattungen die Tribus Aganippini. Ihre Unterfamilie Arbanitinae umfasst etwa 150 Arten in zehn Gattungen und steht in der Familie Idiopidae.[6]
Erstbeschreibung
Die Erstbeschreibung der Gattung Gaius mit der Typusart Gaius villosus erfolgte 1914 durch den australischen Arachnologen William Joseph Rainbow in einer Ausgabe der Records of the Australian Museum. Rainbow beschrieb die Art nach einem weiblichen Exemplar, die von ihm angeführten Gattungs- und Artmerkmale sind daher aus heutiger Sicht nicht für eine Bestimmung geeignet.[35]
Typmaterial
Die Typusart der Gattung Gaius Rainbow, 1914 ist Gaius villosus, aufgrund der Monotypie der Gattung. Der Holotyp von Gaius villosus befindet sich in der Sammlung des Australian Museum in Sydney.[2]
Etymologie
Der Artname Gaius ist nach Angaben des Erstbeschreibers William Joseph Rainbow ein Eigenname aus der Bibel. Dabei kann es sich nur um Gaius von Ephesus handeln, der im Neuen Testament wiederholt erwähnt wird (Röm 16,23 ). Ohne nähere Angaben gab Rainbow als Wortbedeutung an, dass es sich um einen „Lord“ und ein „earthen individual“ handele. Davon leitete er die Bezeichnung für die grabende, also erdbewohnende Spinnengattung ab.[35]
Für den Artnamen villosus lieferte Rainbow in der Erstbeschreibung keine Erklärung. Der Ursprung sind die lateinischen Substantive vellus, mit dem das noch zusammenhängende Vlies aus Schafwolle bezeichnet wurde, und villus für das zottige, wollige Haar der Tiere. Davon abgeleitet bedeutet das Adjektiv villosus im Deutschen zottig, rau, haarig. Der Artname bezieht sich auf die starke Behaarung des Körpers und der Beine von Gaius villosus.[36]
Synonyme und Nomen dubium
Anidiops villosus (Rainbow, 1914): 1957 synonymisierte die australische Arachnologin Barbara York Main die Gattung Gaius mit Anidiops.[37] Gaius wurde 2017 von einer Gruppe um den Arachnologen Michael G. Rix, der auch Main angehörte, als monotypische Gattung mit der Art Gaius villosus wieder eingesetzt.[1]
Gaius hirsutus Rainbow & Pulleine, 1918: die nach nur einem östlich von Port Augusta in South Australia aufgefundenen weiblichen Exemplar beschriebene Art wurde 1957 von Main mit Anidiops manstridgei (Pocock, 1897) (aktuell Idiosoma manstridgei (Pocock, 1897)) synonymisiert.[38][37][39] 2017 wurde die Synonymisierung von Rix et al. aufgehoben und Gaius hirsutus zum Nomen dubium erklärt.[1]
Literatur
- Barbara York Main: Biology of Aganippine trapdoor spiders (Mygalomorphae: Ctenizidae). In: Australian Journal of Zoology 1957, Band 5, Nummer 4, S. 402–473, doi:10.1071/ZO9570402 (Dissertation).
- Barbara York Main: Biology of the arid-adapted Australian trapdoor spider Anidiops villosus (Rainbow). In: Bulletin of the British Arachnological Society 1978, Band 4, Nr. 4, S. 161–175, Online PDF, 1,6 MB.
- Leanda Denise Mason, Grant Wardell-Johnson und Barbara York Main: The longest-lived spider: mygalomorphs dig deep, and persevere. In: Pacific Conservation Biology, 19. April 2018, doi:10.1071/PC18015.
- William Joseph Rainbow: Studies in Australian Araneidae - No. 6. The Terretelariae. In: Records of the Australian Museum 1913–1915, Band 10, Nr. 8, S. 187–270, hier S. 195–199 Digitalisat (Erstbeschreibung, veröffentlicht am 14. August 1914).
- Michael G. Rix et al.: The Australasian spiny trapdoor spiders of the family Idiopidae (Mygalomorphae: Arbanitinae): a relimitation and revision at the generic level. In: Invertebrate Systematics, 2017, Band 31, S. 566–634, doi:10.1071/IS16065.
Einzelnachweise
- Michael G. Rix et al.: The Australasian spiny trapdoor spiders of the family Idiopidae, S. 618–620.
- Michael G. Rix et al.: The Australasian spiny trapdoor spiders of the family Idiopidae, S. 620–621.
- Barbara York Main: Historical ecology, responses to current ecological changes and conservation of Australian spiders. In: Journal of Insect Conservation 2001, Band 5, S. 9–25, doi:10.1023/A:1011337914457.
- Barbara York Main: Biology of the arid-adapted Australian trapdoor spider Anidiops villosus (Rainbow), S. 161.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 444.
- Michael G. Rix et al.: The Australasian spiny trapdoor spiders of the family Idiopidae, S. 569–572.
- Southwestern Australia, Website des WWF, abgerufen am 16. Mai 2018.
- Department of Environment and Conservation (Hrsg.): Threatened Trapdoor Spiders of the Avon. Department of Environment and Conservation und WWF, ohne Ort, ohne Jahr (2009?), Online PDF, 5,0 MB.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 451.
- Barbara York Main: Adaptive Radiation of Trapdoor Spiders. In: Australian Museum Magazine 1957, Band 12, Nr. 5, S. 160–163, Online PDF, 9,0 MB.
- Barbara York Main: Interactions of Water, Plants and Ground-Dwelling Fauna: Water Harvesting and Tapping by Trapdoor Spiders. In: Landscapes. The Journal of the International Centre for Landscape and Language 2010, Band 4, Nr. 1, Artikel 31, Online PDF, 1,7 MB.
- J. R. Henschel: Tool Use by Spiders: Stone Selection and Placement by Corolla Spiders Ariadna (Segestriidae) of the Namib Desert. In: Ethology 1995, Band 101, Nr. 3, S. 187–199, doi:10.1111/j.1439-0310.1995.tb00357.x.
- Barbara York Main: An unusual method of spoil disposal during burrow excavation by the trapdoor spider Anidiops villosus (Rainbow). In: The Western Australian Naturalist 1979, Band 14, Nr. 5, S. 115–117, ISSN 0508-4865.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 447–448.
- Barbara York Main: Survival of trapdoor spiders during and after fire. In: CALM Science Supplement 1995, Band 4, S. 207–216, Online PDF, 132 kB.
- Barbara York Main: Biology of the arid-adapted Australian trapdoor spider Anidiops villosus (Rainbow), S. 164–166.
- Barbara York Main: Biology of the arid-adapted Australian trapdoor spider Anidiops villosus (Rainbow), S. 162–164.
- Barbara York Main: Biology of the arid-adapted Australian trapdoor spider Anidiops villosus (Rainbow), S. 173.
- Barbara York Main: Biology of the arid-adapted Australian trapdoor spider Anidiops villosus (Rainbow), S. 170–171.
- Barbara York Main: Distribution and Adaptive Diversity of Trapdoor Spiders. In: Australian Natural History 1968, Band 16, Nr. 2, S. 49–53, Online PDF, 9,1 MB.
- Barbara York Main: Biology of the arid-adapted Australian trapdoor spider Anidiops villosus (Rainbow), S. 171–172.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 454–455.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 452.
- Barbara York Main: Taxonomy and biology of the genus Isometroides Keyserling (Scorpionida). In: Australian Journal of Zoology 1956, Band 4, Nr. 2, S. 158–164, doi:10.1071/ZO9560158.
- L. E. Koch: The taxonomy, geographic distribution and evolutionary radiation of Australo-Papuan Scorpions. In: Records of the Western Australian Museum 1977, Band 7, Teil 2, S. 144–151, Online PDF, 24,4 MB.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 449.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 453–454.
- Leanda Denise Mason, Grant Wardell-Johnson und Barbara York Main: The longest-lived spider: mygalomorphs dig deep, and persevere, S. B–C.
- Alan L. Yen: Australian spiders: an opportunity for conservation. In: Records of the Western Australian Museum Supplement 1995, Nr. 52, S. 39–47, ISSN 0313-122X, Digitalisat.
- Michael G. Rix et al.: Where have all the spiders gone? The decline of a poorly known invertebrate fauna in the agricultural and arid zones of southern Australia. In: Austra Entomology 2016, Band 56, Nr. 1, S. 14–22, doi:10.1111/aen.12258.
- Barbara York Main: Biology of the arid-adapted Australian trapdoor spider Anidiops villosus (Rainbow), S. 174.
- A. Chapman: Introduction to Yorkrakine Rock, East Yorkrakine and North Bungulla Nature Reserves. In: Records of the Western Australian Museum Supplement 1980, Nr. 12, S. 9–13, ISSN 0313-122X, Digitalisat.
- Leanda Denise Mason, Grant Wardell-Johnson und Barbara York Main: The longest-lived spider: mygalomorphs dig deep, and persevere, S. A.
- Robyn Williams, Vicki Laurie und Barbara Yok Main: Barbara York Main: Spider Woman, Transkript eines Radiointerviews, gesendet von der Australian Broadcasting Corporation in der Sendung Ockham’s Razor vom 15. September 2013, abgerufen am 18. Mai 2018.
- William Joseph Rainbow: Studies in Australian Araneidae.
- Alois Walde: Lateinisches Etymologisches Wörterbuch, zweite umgearbeitete Auflage. Carl Winter, Heidelberg 1910, Digitalisat, Lemmata vellus und villus.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 426–427.
- Barbara York Main: Biology of Aganippine trapdoor spiders, S. 411.
- William Joseph Rainbow und Robert H. Pulleine: Australian Trapdoor spiders. In: Records of the Australian Museum 1918, Band 12, Nr. 7, S. 81–169, Tafeln xii–xxiv, hier S. 83, 102–103, Tafel xxi, Digitalisat.
Weblinks
Gaius im World Spider Catalog Gaius villosus im World Spider Catalog