Feglymycin
Bei Feglymycin handelt es sich um ein Virostatikum und um ein Antibiotikum. Es konnte durch Festphasenextraktion, Gel-Permeations-Chromatographie und Reversed Phase Chromatographie aus Kulturen von Streptomyces sp. DSM 11171 gewonnen werden.
| Feglymycin | ||
|---|---|---|
| ||
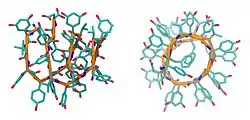
| 3D-Struktur des Feglymycin-Dimers als Stäbchenmodell, von der Seite und vorn, nach PDB 1W7R | ||
| Masse/Länge Primärstruktur | 13 aa; 1.900,882 g/mol, C95H97N13O30 | |
| Bezeichner | ||
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Streptomyces | |
Eigenschaften
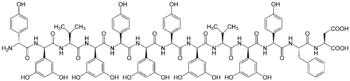
Feglymycin ist ein Protein aus 13 Aminosäuren, wobei die nichtproteinogenen Aminosäuren 4-Hydroxyphenylglycine (vier Stück) und 3,5-Dihydroxyphenylglycine (fünf Stück) mehrheitlich alternierend angeordnet sind. Es bildet asymmetrische Dimere mit einer antiparallelen, doppelsträngigen Doppel-β9.0-Helix.[1]
In vitro zeigte Feglymycin eine Wirkung gegen das Humane Immundefizienz-Virus[2] und gegen Staphylococcus aureus. Die antivirale Wirkung erfolgt durch eine Hemmung der Bindung von gp120 an CD4.[2] Die antibiotische Wirkung entsteht durch eine Hemmung der Enzyme MurA und MurC der bakteriellen Peptidoglykan-Biosynthese.[3][4] Dabei ist ein Aspartat an der Position 13 essentiell.[4]
Die Biosynthese von Feglymycin erfolgt durch nichtribosomale Peptidsynthese,[5] an der 19 Proteine beteiligt sind (FegA–FegS).
2009 wurde die Totalsynthese von Feglymycin publiziert,[6] 2016 eine weitere.[7]
Einzelnachweise
- Bunkóczi, Gábor: Structure determination of peptides with antimicrobial action (PDF; 14,4 MB).
- G. Férir, A. Hänchen, K. O. François, B. Hoorelbeke, D. Huskens, F. Dettner, R. D. Süssmuth, D. Schols: Feglymycin, a unique natural bacterial antibiotic peptide, inhibits HIV entry by targeting the viral envelope protein gp120. In: Virology. Band 433, Nummer 2, November 2012, S. 308–319, doi:10.1016/j.virol.2012.08.007, PMID 22959895.
- S. Rausch, A. Hänchen, A. Denisiuk, M. Löhken, T. Schneider, R. D. Süssmuth: Feglymycin is an inhibitor of the enzymes MurA and MurC of the peptidoglycan biosynthesis pathway. In: Chembiochem : a European journal of chemical biology. Band 12, Nummer 8, Mai 2011, S. 1171–1173, doi:10.1002/cbic.201100120, PMID 21538763.
- A. Hänchen, S. Rausch, B. Landmann, L. Toti, A. Nusser, R. D. Süssmuth: Alanine scan of the peptide antibiotic feglymycin: assessment of amino acid side chains contributing to antimicrobial activity. In: Chembiochem: a European journal of chemical biology. Band 14, Nummer 5, März 2013, S. 625–632, doi:10.1002/cbic.201300032, PMID 23447362.
- M. Gonsior, A. Mühlenweg, M. Tietzmann, S. Rausch, A. Poch, R. D. Süssmuth: Biosynthesis of the Peptide Antibiotic Feglymycin by a Linear Nonribosomal Peptide Synthetase Mechanism. In: Chembiochem : a European journal of chemical biology. Band 16, Nummer 18, Dezember 2015, S. 2610–2614, doi:10.1002/cbic.201500432, PMID 26515424.
- Frank Dettner, Anne Hänchen, Dominique Schols, Luigi Toti, Antje Nußer, Roderich D. Süssmuth: Totalsynthese des antiviralen Peptidantibiotikums Feglymycin. In: Angewandte Chemie. 121, 2009, S. 1888, doi:10.1002/ange.200804130.
- S. Fuse, Y. Mifune, H. Nakamura, H. Tanaka: Total synthesis of feglymycin based on a linear/convergent hybrid approach using micro-flow amide bond formation. In: Nature Communications. Band 7, November 2016, S. 13491, doi:10.1038/ncomms13491, PMID 27892469, PMC 5133696 (freier Volltext).