Dornteufel
Der Dornteufel (Moloch horridus) oder Moloch ist eine in Australien heimische Art der Agamen. Er ist die einzige Art der Gattung Moloch. Die recht kleine, orangerote Echse ist aufgrund ihres komplett von Stacheln bedeckten Körpers unverwechselbar.
| Dornteufel | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Dornteufel (Moloch horridus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Moloch | ||||||||||||
| J. E. Gray, 1841 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Moloch horridus | ||||||||||||
| J. E. Gray, 1841 |
Der Dornteufel bewohnt die Trockengebiete von Zentral- und Westaustralien, wo er sich als Versteck einen kleinen Bau anlegt, in dem er die Nacht, die komplette Trockenzeit und die heißen Sommermonate verbringt. Im Frühling und Herbst ist er vormittags und nachmittags aktiv und geht auf Nahrungssuche. Der Dornteufel ernährt sich ausschließlich von Ameisen (Myrmekophagie); dazu stellt er sich neben eine Ameisenstraße und leckt die Insekten mit der Zunge auf. Da es in der Wüste nur wenig Trinkwasser gibt, entwickelte sich ein System aus mikroskopischen Rillen in seiner Haut, die durch Kapillarkräfte Wasser aus Regenfall und Nebel zu seinem Maul transportieren.
Merkmale


Ausgewachsene, weibliche Dornteufel haben eine Kopf-Rumpf-Länge von 8–11 cm und wiegen bis zu rund 89 g, während Männchen mit maximal 9,6 cm und höchstens 49 g deutlich kleiner bleiben.[1] Die Art ist generell recht stämmig gebaut und hat nur einen kurzen Schwanz. Das auffälligste Merkmal sind die ausgeprägten, dornartigen Stacheln an Kopf, Rumpf, Beinen und Schwanz. Auf dem Nacken findet sich ein auffälliger, stacheliger Höcker.[2] Alle Stacheln des Dornteufels sind aus Keratin gebildet.[3]
Die Tiere sind orangerot bis gelb gefärbt und weisen schwarze Flecken und helle Längsstreifen auf.[2] Die Grundfarbe wird von der Farbe des Sands bestimmt, Individuen aus Gebieten mit rötlichem Sand sind z. B. tendenziell rötlicher gefärbt als andere Populationen.[1] Außerdem besitzt der Dornteufel die Fähigkeit zum physiologischen Farbwechsel, der sich in der helleren Färbung von aktiven Dornteufeln äußert.[4]
Der Kot von Dornteufeln ist glänzend schwarz, eiförmig, verhältnismäßig groß und praktisch unverwechselbar. Dornteufel legen in ihren Aktionsräumen oft spezielle Stellen an, an denen sie regelmäßig ihren Kot absetzen – solche Ansammlungen von bis über 20 Kotbällchen deuten auf die Präsenz von Dornteufeln hin.[1][5]
Der Dornteufel läuft mit ruckartigen Bewegungen und hält seinen Schwanz kurvenartig nach oben.[2]
Lebensweise
Verhalten
Dornteufel sind tagaktive Einzelgänger. Sie nutzen selbst gegrabene Baue von 5 bis 10 cm Tiefe als Versteck,[4] oder aber sie verstecken sich zwischen Gräsern.[1]
Während der kältesten (Juni, Juli) und der wärmsten (Januar, Februar) Monate bleiben Dornteufel weitestgehend inaktiv in ihrem Versteck. Aktiv sind sie im Herbst und insbesondere von spätem Winter bis frühen Sommer, wenn Paarung und Eiablage stattfinden.[1] Während des restlichen Jahres ist das Aktivitätsmuster bimodal. Die Nacht ruhen sie in ihrem Versteck, um sich dann am Morgen zu sonnen. Am späten Morgen suchen sie nach Nahrung, verbringen die heiße Mittagszeit in ihrem Unterschlupf, und gehen Nachmittags wieder auf Nahrungssuche.[4]
Bei radiotelemetrischen Untersuchungen in der Großen Victoria-Wüste legten männliche Dornteufel im Schnitt 66,6 m pro Tag zurück, Weibchen hingegen nur 31,7 m. In einem Einzelfall legte ein Männchen rund 300 m an einem Tag zurück. Es ist nicht bekannt, ob Dornteufel einen über lange Zeit genutzten Aktionsraum haben; da Ameisen räumlich oft ungleich und wechselnd verteilt sind, handelt es sich beim Dornteufel vielleicht um einen Halbnomaden.[4]
Ernährung
Der Dornteufel ernährt sich ausschließlich von kleinen, schwarzen Ameisen aus der einstigen Iridomyrmex-Gruppe, die nun auf zahlreiche weitere Gattungen verteilt ist.[1][6] Normalerweise werden etwa 750 Ameisen täglich erbeutet, die dann im Magen 1–2 cm³ einnehmen.[1][5] Im Magen des Dornteufels können bis zu 2500 Ameisen gefunden werden, welche dann um die 5 cm³ einnehmen.[1]
Zur Jagd auf Ameisen positionieren sich Dornteufel neben einer Ameisenstraße; diese braucht nicht am Boden zu verlaufen, Dornteufel erbeuten auch baumbewohnende Ameisen. Dazu lauern sie an Baumstämmen, stehen dabei manchmal aufrecht und stützen sich mit den Vorderbeinen am Stamm ab.[5] Die Tiere platzieren sich sehr nahe an den Ameisenstraßen und fangen die Ameisen mit der Zunge. Der Dornteufel ist der schnellste bekannte Fresser unter den Leguanartigen (1 Ameise/350 ms), was sich mit einer Reihe von Anpassungen erklären lässt. Die meisten Echsen stürzen sich in einer Vorwärtsbewegung auf ihre Beute und öffnen ihr Maul anfangs langsamer als zum Ende hin. Der Dornteufel hingegen muss sich nicht auf die Ameisen stürzen, da er sich nahe an Ameisenstraßen begeben kann und einen verhältnismäßig langen Hals hat. Statt anfangs sein Maul langsam zu öffnen, öffnet er es gleich mit maximaler Geschwindigkeit und lässt dabei die Zunge hervorschnellen. Auch braucht der Dornteufel nur wenig Zeit zum Schlucken.[7] Freilebende Dornteufel verzehren Ameisen mit Raten von bis zu 12 Ameisen/min, über kurze Zeiträume auch 1 Ameise/sec.[5]
Wasserhaushalt
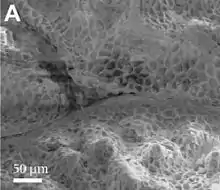
Die Mikrostruktur seines Schuppenkleides ermöglicht ihm, Wassertropfen aus Tau, Nebel und dem sehr seltenen Regen aufzunehmen, die von der Struktur seiner Körperoberfläche zum Mund geleitet werden. Die oberste Keratinschicht der Schuppen ist wabenförmig skulpturiert; diese Waben haben Durchmesser von 10–20 Mikrometern und sind 5 μm tief. Diese Oberflächenstruktur macht die Körperoberfläche des Dornteufels stark hydrophil und Wassertropfen verlaufen auf der Haut eines Dornteufels zu einem dünnen Wasserfilm und nicht vom Tier herunter. Das Wasser läuft dann in einem System mikroskopisch kleiner Rillen zwischen den Schuppen durch Kapillarkraft zum Mund des Dornteufels.[8][9]
Stehendes Wasser ist oft nicht verfügbar und wird nicht getrunken. Der Dornteufel verstoffwechselt täglich 0,3 ml Wasser, was für eine Echse seiner Größe vergleichsweise wenig ist.[5]
Fortpflanzung und Entwicklung
Über die Fortpflanzung des Dornteufels in der Natur ist nur wenig bekannt. Es wird nur ein Gelege pro Jahr produziert. Nach Untersuchungen von Ovarialfollikeln und Hoden scheint es, dass Paarungen sowohl im Herbst (Mai) als auch im Frühling (August und September) stattfinden. Die Eiablage erfolgt jedoch nur im späten Frühling – einige Weibchen speichern Sperma von Paarungen aus dem letzten Herbst. Es ist nicht bekannt, wie sich Partner finden, es wurden jedoch schon Paarungsansammlungen von zwei Männchen und zwei Weibchen beobachtet.[1]
In der Großen Victoria-Wüste wurden drei Weibchen bei der Eiablage beobachtet; sie legten ihre Eier im September, Oktober oder November in selbst gegrabene Nistkammern. Hohlräume als Nest sind unter Reptilien ungewöhnlich; die meisten Arten legen ihre Eier in loses Substrat. Die Gelege umfassten 6–7 Eier und machten 34,2–41,7 % des Körpergewichts der trächtigen Weibchen aus. Die Jungtiere schlüpften nach 124 bis 127 Tagen und besaßen im Schnitt eine Kopf-Rumpf-Länge von 3,57 cm. Die Jungtiere fressen nach dem Schlupf die Eierschalen – eine für Schuppenkriechtiere ungewöhnliche Verhaltensweise. Dies dient wahrscheinlich zur Kalziumversorgung. Das Auffinden der Eierschalen wird durch eine luftgefüllte Nistkammer erleichtert.[10]
Dornteufel wachsen bis zu ihrem 6. Lebensjahr; Männchen bleiben kleiner als Weibchen, da ihre Wachstumsgeschwindigkeit früher abnimmt. Die Lebenserwartung liegt bei maximal 20 Jahren.[1]
Verbreitung und Lebensraum
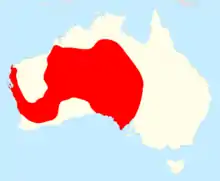
Der Dornteufel bewohnt insbesondere die Trockengebiete Zentralaustraliens in SW-Queensland, South Australia, das S-Northern Territory und Western Australia. Ungesichert, aber möglich sind Vorkommen in der Nullarbor-Wüste sowie in NW-New South Wales. Im Großteil seines Verbreitungsgebietes bewohnt der Dornteufel Sandwüste mit Spinifex-Bewuchs, Akazien ("Mulga") und Eukalypten, insbesondere in SW-Western Australia sind auch Vorkommen im Mallee bekannt. Auf Steinböden ist die Art selten.[1]
Natürliche Feinde und Feindvermeidung
Zu den Jägern von Dornteufeln gehören Greifvögel, Schlangen, Dingos, Füchse[1] und Warane. Wenn sich ein Räuber nähert, erstarren Dornteufel in ihrer momentanen Position, oft mit noch einem angehobenen Bein. So sind sie kaum zu erkennen, insbesondere durch ihre Stacheln sind sie gut getarnt. Die Stacheln verletzen jedoch nicht die Magenwände von Beutegreifern.[3]
Systematik
Die Erstbeschreibung des Dornteufels erfolgte 1841 durch den Zoologen John Edward Gray (1800–1875),[11] der sich auf ein 1840 von John Gould (1804–1881) in London ausgestelltes Exemplar bezog. Den Gattungsnamen Moloch leitete Gray vom Moloch-Kult ab, horridus könnte auf Lateinisch sowohl für die raue, stachelige Körperbedeckung des Dornteufels als auch für "schrecklich" stehen.[3]
Vom Dornteufel sind keine Unterarten anerkannt.[2]
Phylogenie
Die Phylogenie der australischen Agamen wurde durch kladistische Analysen sowohl von mtDNA[12] als auch von nukleärer DNA aufgeklärt. Demnach kommt dem Dornteufel in der mesischen (feuchtigkeitsliebenden, oft im Regenwald) Radiation der australischen Agamen die Sonderstellung als einzige trockenheitsliebende (xerische) Art zu. Während alle anderen in Trockengebieten lebenden, australischen Agamen (z. B. Pogona) in einem als Amphibolurinae bezeichneten Taxon vereinigt sind, stellt die evolutionäre Linie zum Dornteufel eine unabhängige Anpassung an die Trockenheit Australiens dar. Der Dornteufel ist wahrscheinlich der letzte Überlebende einer basalen mesischen Gruppe, die sich laut molekularer Uhr bereits vor 18 Millionen Jahren von den Regenwaldbewohnern abspaltete.[13]
Der Dornteufel gilt als australisches Äquivalent der Krötenechsen (Phrynosoma) in den Trockengebieten Nordamerikas, die sich ebenfalls durch Stacheln und eine Ernährung von Ameisen auszeichnen. Es handelt sich um konvergente Evolution, die Gattungen Moloch und Phrynosoma sind nicht näher verwandt.[1]
Weblinks
- Australia's Thorny Devil – der Herpetologe Eric Pianka über seine Arbeit am Dornteufel
- digimorph.com – anatomische Scans und Beschreibung des Körperbaus, Vergleich zwischen Dornteufel und Krötenechsen (Phrynosoma)
- Moloch horridus In: The Reptile Database
- Moloch horridus – Eintrag in der GenBank
Literatur
- P. J. Bentley & F. C. Blumer (1962): Uptake of water by the lizard, Moloch horridus. Nature 194: 699–700
- A. F. Hugall, R. Foster, M. Hutchinson & M. S. Y. Lee (2008): Phylogeny of Australasian agamid lizards based on nuclear and mitochondrial genes: implications for morphological evolution and biogeography. Biological Journal of the Linnean Society 93: 343–358
- E. R. Pianka & H. D. Pianka (1970): The Ecology of Moloch horridus (Lacertilia: Agamidae) in Western Australia. Copeia 1970(1): 90–103
- G. A. Pianka, E. R. Pianka & G. G. Thompson (1998): Natural history of thorny devils Moloch horridus (Lacertilia: Agamidae) in the Great Victoria Desert. Journal of the Royal Society of Western Australia 81: 183–190
- S. Wilson & G. Swan (2010): A complete guide to reptiles of Australia: 380. New Holland Publishers, Sydney, Auckland, London, Cape Town (3. Aufl.). ISBN 9781877069765
- P. C. Withers & C. R. Dickman (1995): The role of diet in determining water, energy and salt intake in the thorny devil Moloch horridus (Lacertilia: Agamidae). Journal of the Royal Society of Western Australia 78: 3–11
Einzelnachweise
- E. R. Pianka & H. D. Pianka (1970): The Ecology of Moloch horridus (Lacertilia: Agamidae) in Western Australia. Copeia 1970(1): 90-103
- S. Wilson & G. Swan (2010): A complete guide to reptiles of Australia: 380. New Holland Publishers, Sydney, Auckland, London, Cape Town (3. Aufl.). ISBN 9781877069765
- E. R. Pianka: Australia's Thorny Devil (http://www.zo.utexas.edu/courses/thoc/moloch.html). Abgerufen am 23. Juni 2018
- G. A. Pianka, E. R. Pianka & G. G. Thompson (1998): Natural history of thorny devils Moloch horridus (Lacertilia: Agamidae) in the Great Victoria Desert. Journal of the Royal Society of Western Australia 81: 183-190
- P. C. Withers & C. R. Dickman (1995): The role of diet in determining water, energy and salt intake in the thorny devil Moloch horridus (Lacertilia: Agamidae). Journal of the Royal Society of Western Australia 78: 3-11
- S. O. Shattuck (1992): Review of the dolichoderinae ant genus Iridomyrmex Mayr with descriptions of three new genera (Hymenoptera: Formicidae). Journal of the Australian Entomological Society 31: 13-18
- J. J. Meyers & A. Herrel (2005): Prey capture kinematics of ant-eating lizards. Journal of Experimental Biology 208: 113-127
- P. J. Bentley & F. C. Blumer (1962): Uptake of water by the lizard, Moloch horridus. Nature 194: 699-700
- P. Comanns, C. Effertz, F. Hischen, K. Staudt, W. Böhme & W. Baumgartner (2011): Moisture harvesting and water transport through specialized micro-structures on the integument of lizards. Beilstein Journal of Nanotechnology 2: 204–214 doi:10.3762/bjnano.2.24
- G. A. Pianka, E. R. Pianka & G. G. Thompson: Egg laying by thorny devils (Moloch horridus) under natural conditions in the Great Victoria Desert. Journal of the Royal Society of Western Australia 79: 195-197
- J. E. Gray (1841): Description of some new species and four new genera of reptiles from Western Australia, discovered by John Gould. Esq. Ann. Mag. Nat. Hist.
- J. A. Schulte, J. Melville & A. Larson (2003): Molecular phylogenetic evidence for ancient divergence of lizard taxa on either side of Wallace’s Line. Proceedings of the Royal Society of London Series B 270: 597–603
- A. F. Hugall, R. Foster, M. Hutchinson & M. S. Y. Lee (2008): Phylogeny of Australasian agamid lizards based on nuclear and mitochondrial genes: implications for morphological evolution and biogeography. Biological Journal of the Linnean Society 93: 343–358