Diminution (Chromatin)
Als Diminution oder Chromatindiminution wird ein Prozess bezeichnet, bei dem Teile der Chromosomen einer Zelle gezielt abgebaut werden, so dass Tochterzellen weniger Chromatin haben, als die Vorläuferzellen. Hier liegt somit eine Ausnahme von der Regel vor, nach der Tochterzellen grundsätzlich die gleiche chromosomale Ausstattung erhalten wie die Vorläuferzellen.
Der Prozess wird unterschieden von der Chromosomenelimination, bei der ganze Chromosomen abgebaut werden.[1]
Der Vorgang wurde erstmals 1887 von Theodor Boveri an Eiern eines Spulwurms, genauer des Pferdespulwurms (Parascaris equorum, zu Boveris Zeiten noch Ascaris megalocephala genannt) beschrieben.[2]
Vorgänge in Spulwürmern
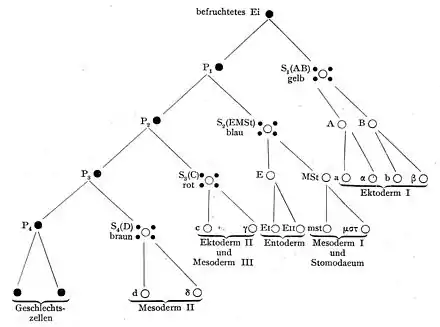
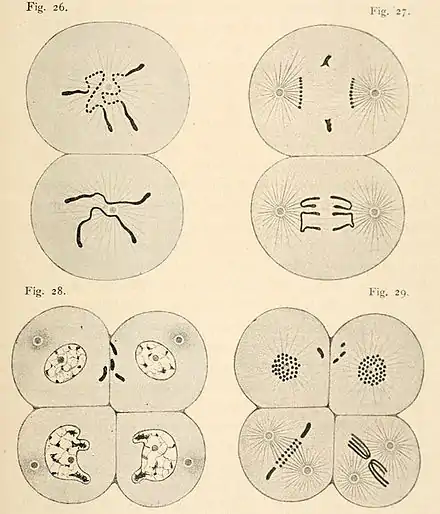
Beim von Boveri untersuchten Pferdespulwurm teilt sich das befruchtete Ei und in einer der Tochterzellen (P1) erhalten sich die „Urchromosomen“ (Boveri). In der anderen findet Diminution statt. Nach drei weiteren Teilungen von P1 entsteht aus einem der Nachkommen der Vorläufer der Keimzellen oder Geschlechtszellen. Die jeweils andere Tochterzelle untergeht wiederum der Diminution.[3]
Die von Boveri beschriebenen Abläufe sind aus der nebenstehenden Zeichnung ersichtlich: Fig. 26: Die befruchtete Eizelle hat sich bereits einmal geteilt und steht kurz vor der zweiten Teilung. Die Chromosomen sind bereits kondensiert (in Metaphase). Die obere Tochterzelle (S1) wird nur somatische Zellen als Nachfahren haben, die Defragmentierung der beiden Chromosomen als erster Schritt der Diminution hat bereits eingesetzt. Die untere Zelle (P1) ist Vorläuferin der Keimzellen und weiterer somatischer Zellen. Hier sind noch die unveränderten „Urchromosomen“ vorhanden. Fig. 27: Beide Zellen sind jetzt in der Kernteilung, genauer in der Anaphase und die verdoppelten Chromosomen werden für die Tochterzellen aufgeteilt. In der oberen Zelle bleiben die abgesonderten Chromosomenbruchstücke in der Äquatorialebene zurück. Fig 28.: Nach abgeschlossener Teilung sind an der Grenze der oberen Tochterzellen noch die abzubauenden Chromosomenbruchstücke sichtbar. Alle Zellen sind jetzt in Interphase. Fig 29: In der nächsten Anaphase wird deutlich dass die beiden unteren Zellen ebenfalls unterschiedliche Schicksale haben: Die Zelle links unten (S2(EMSt)) durchläuft ebenfalls Diminution. Die Zelle rechts unten (P2) behält die vollständigen Chromosomen. Bei zwei weiteren Teilungen entsteht zunächst die Tochterzelle P3 und aus dieser P4, aus der die Geschlechtszellen hervorgehen werden. Die jeweils anderen Tochterzellen durchlaufen die Diminution.[3][4]
In den somatischen Zellen setzt die Diminution mit einer Fragmentierung der „Urchromosomen“ an spezifischen chromosomalen Regionen an. Neue Telomere entstehen, so dass alle noch benötigten Fragmente weitergegeben werden können. Die Mechanismen der Bruchstellenauswahl und der Fragmentierung sind nicht bekannt. Die DNA zwischen einer Bruchstelle und dem Telomer (mit allen darin enthaltenen Genen) wird abgebaut und an der Bruchstelle wird durch Anlagerung der Konsensussequenz TTAGGC ein neues Telomer erzeugt. Vermutlich geschieht dies durch Telomerase und nicht durch Rekombination mit dem alten Telomer. Bei der nächsten Kernteilung lagern sich die Mikrotubuli des Spindelapparats nur an die neuen, verkürzten Chromosomen an, nicht aber an die abgeschnittenen Fragmente, die in der Anaphase in der Äquatorialplatte liegen bleiben und dann enzymatisch abgebaut werden. Die abgestoßene DNA enthält hauptsächlich repetitive Sequenzen.[1]
Genauere Untersuchungen an Ascaris suum ergaben, dass von den 334 Millionen Basenpaaren an DNA, die in der Keimbahn vorhanden sind 13 % in den somatischen Zellen abgebaut werden. 52 Bruchpunkte wurden identifiziert, an denen eine anschließende Stabilisierung durch Telomer-Bildung stattfand. Eine Verbindung verschiedener Bruchstücke zu neuen Chromosomen konnte nicht nachgewiesen werden. Die entfernte DNA enthielt mit 70 % hauptsächlich eine 121 Basenpaar lange repetitive Satelliten-DNA. Die restlichen 12,7 Millionen Basenpaare waren jedoch nicht-repetitiv und enthielten fast 700 gene. Das entspricht etwa 4 % aller Gene. Für diese Gene konnte eine Transkription tatsächlich nur in der Keimbahn und im frühen Embryo nachgewiesen werden. Diese Daten lassen vermuten, dass eine Rolle der Diminution darin bestehen könnte, keimbahnspezifische Gene aus den somatischen Zellen zu entfernen.[2]
Verbreitung
Diminution wurde nicht nur bei Nematoden (bei Ascaris, Parascaris und Strongyloides[5], nicht aber bei Caenorhabditis elegans) gefunden. Sie wurde auch beschrieben bei Ruderfußkrebsen (Copepoda), Wimpertierchen (Ciliaten)[6][7], beim Meerneunauge und bei einer Lauchart.
Bei den Copepoden ist Diminution mittlerweile bei über 20 Süßwasser-Arten beschrieben, darunter mehrere Hüpferling-Arten (Cyclops). Dabei verlieren die somatische Zellen zwischen 45 und 94 % der Ausgangs-DNA. Es werden große Mengen Heterochromatins entfernt.[8]
Beim Meerneunauge (Petromyzon marinus) werden während der frühen Embryonalentwicklung etwa 20 % der Keimbahn-DNA aus den somatischen Zellen entfernt. Dabei werden neben großen Mengen repetitiver DNA auch hunderte bis tausende Gene entfernt, darunter solche die in Grundfunktionen der zelle wie Transkription involviert sind. Wie in Ascaris suum konnten auch hier keine konservierten Sequenzen an den Bruchpunkten gefunden werden. Jedoch wurden an einigen Bruchpunkten palindromische Sequenzen gefunden.[2]
Guranda Gwaladse und Kollegen beschrieben Diminution in einer Pflanzenart, Allium atroviolaceum, die zur Gattung Lauch gehört.[9]
Funktion
Es wird diskutiert, dass Diminution eine alternative Form der Genregulation ist.[6] Die oben beschriebenen neueren Studien an Ascaris suum und Petromyzon marinus legen nahe, dass Diminution eine effektive Methode ist, um somatischen Zellen die Kosten für die Replikation und Erhaltung von dort nicht benötigter DNA zu ersparen und die Expression von Keimbahn-spezifischen Genen sehr effektiv zu verhindern.[2]
Einzelnachweise
- Scott F. Gilbert: Developmental Biology. Zehnte Auflage. Sinauer Associates, Inc., 2013, ISBN 978-1-60535-192-6, Chapter 17.1, Chromatin Diminution. (online version). online version (Memento des Originals vom 28. Februar 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- A. Streit: Silencing by throwing away: a role for chromatin diminution. In: Developmental cell. Band 23, Nummer 5, November 2012, S. 918–919, doi:10.1016/j.devcel.2012.10.022, PMID 23153488.
- Theodor Boveri: Die Potenzen der Ascaris-Blastomeren bei abgeänderter Furchung. In: Festschrift zum sechzigsten Geburtstag Richard Hertwigs. Band III. Verlag von Gustav Fischer, Jena 1910, S. 133–214 (Mit 6 Tafeln und 24 Textfiguren).
- S. Pimpinelli, C. Goday: Unusual kinetochores and chromatin diminution in Parascaris. In: Trends in genetics : TIG. Band 5, Nummer 9, September 1989, S. 310–315, PMID 2686123 doi:10.1016/0168-9525(89)90114-5, (Review).
- A. Streit: How to become a parasite without sex chromosomes: a hypothesis for the evolution of Strongyloides spp. and related nematodes. In: Parasitology. Band 141, Nummer 10, September 2014, S. 1244–1254, doi:10.1017/S003118201400064X, PMID 24829037 (Review).
- F. Müller, V. Bernard, H. Tobler: Chromatin diminution in nematodes. In: BioEssays : news and reviews in molecular, cellular and developmental biology. Band 18, Nummer 2, Februar 1996, S. 133–138, doi:10.1002/bies.950180209, PMID 8851046 (Review).
- Heinz Tobler, Fritz Müller: Chromatin Diminution. In: eLS. 2001, doi:10.1038/npg.els.0001181.
- A. Grishanin: Chromatin diminution in Copepoda (Crustacea): pattern, biological role and evolutionary aspects. In: Comparative cytogenetics. Band 8, Nummer 1, 2014, S. 1–10, doi:10.3897/CompCytogen.v8i1.5913, PMID 24744830, PMC 3978239 (freier Volltext).
- G. Gvaladze, N. Nadirashvili, M. Akhalkatsi: Chromatin diminution during endosperm development in Allium atroviolaceum Boiss. (Alliaceae). In: Bull. Georg. Acad. Sci. Band 166, Nr. 3, 2002, S. 537–540 (erste Seite online [PDF]). erste Seite online (Memento des Originals vom 28. Februar 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.