Davies-Gleichung
Die Davies-Gleichung ist eine Gleichung zur Abschätzung von Aktivitätskoeffizienten und damit von Aktivitäten in wässrigen Lösungen von Salzen (Elektrolyt). Die Gleichung wurde erstmals 1938 von Cecil Whitfield Davies vorgeschlagen[1] und später durch weitere Arbeiten von ihm untermauert[2] und ist deswegen nach ihm benannt. Sie baut auf den Ergebnissen der Debye-Hückel-Theorie auf, die für verdünnte Lösungen gültig ist. Sie erweitert deren Gleichung für die Aktivitätskoeffizienten so, dass sie auch für konzentriertere Lösungen brauchbar ist; die Erweiterung wurde rein empirisch gefunden. Die Gleichung wird häufig zur Berechnung von chemischen Gleichgewichten verwendet und ist in vielen entsprechenden Programmen implementiert.
Die Daviesgleichung gibt den Zusammenhang zwischen der Ionenstärke I einer Lösung und dem Mittelwert der ionischen Aktivitätskoeffizienten f (bzw. dessen dekadischem Logarithmus). Bei Temperaturen um 25 °C lautet die Gleichung:
mit
- I: Zahlenwert der Ionenstärke ohne die Einheit Mol/Liter
- zi: Ladungszahl der Ionen
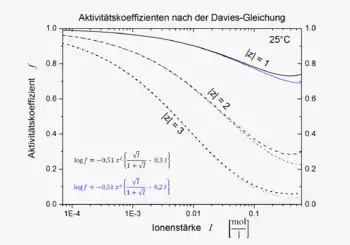
Die Daviesgleichung ist für Ionenstärken von 0 bis etwa 0,5 mol/l eine gute Näherung; das ist ein deutlich größerer Bereich als der des erweiterten Debye-Hückel-Grenzgesetzes, das bis etwa 10−2 mol/l gilt. Für konzentriertere Lösungen mit I > 0,5 mol/l ist die Daviesgleichung kaum geeignet. In diesem Fall sollten andere Beziehungen, z. B. die nach Pitzer, angewandt werden.
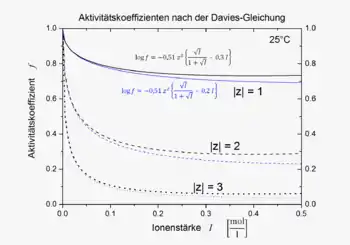
Im Vergleich zum entsprechenden Ergebnis der Debye-Hückel-Theorie wurde ein weiterer einfacher Term angefügt, in den die Ionenstärke linear eingeht. Der Koeffizient im linearen Term wurde dabei von Davies ursprünglich als 0,2 angegeben[1] und später auf 0,3 geändert.[2] Die Davies-Gleichung gibt für alle Ionen mit derselben Ladung denselben Aktivitätskoeffizienten; die Größe der Ionen geht nicht in sie ein. Sie ist in der Regel ungenauer als spezifischere Gleichungen mit mehreren Parametern.
Erweiterte Davies-Gleichung
Die ursprünglich von Davies vorgeschlagene Gleichung gilt für 25 °C. Allgemeiner ist die Davies-Gleichung in der Form
mit dem temperaturabhängigen Parameter A, der aus der Debye-Hückel-Theorie übernommen wird. Die Formel zur Berechnung des Parameters und Werte sind hier angegeben. Auch in dieser Gleichung wird teilweise der Zahlenwert 0,2 statt 0,3 verwendet.[3] Manche Autoren empfehlen stattdessen den Wert 0,1.[4][5]
Historisches
Schon Erich Hückel hatte vorgeschlagen, dem erweiterten Debye-Hückel-Grenzgesetz einen linearen Term anzufügen, und auch Edward Guggenheim hatte entsprechende Gleichungen diskutiert.[6] Beispielsweise gilt für Salzsäure HCl(aq), für die die Ionenstärke I gleich der Konzentration c ist, bis zu einmolaler Lösung die Gleichung:[6]
1936 gab Guggenheim eine Gleichung für einwertige Ionen (I = c) an, die einen linearen Term mit einem von der Ionensorte abhängigen Parameter λ enthält.[7] Sie kann geschrieben werden als
- ,
wobei = 0,5 bei 15 °C bis 25 °C und = 0,486 bei 0 °C. Diese Gleichung wird heute auch Guggenheim-Gleichung genannt. Darauf aufbauend schlug Davies seine Gleichung als Näherung vor,[1] wobei er statt des ionenspezifischen Parameters λ einen Wert verwendete, der sich aus dem Mittelwert der damals bekannten λ-Werten ergab.
Anwendungen
Die Davies-Gleichung wird z. B. in der Geochemie verwendet[8], insbesondere in der Bodenkunde[9][10], ferner in der Hydrochemie.[11][12]
Konzentriertere Lösungen
Für höher konzentrierte Elektrolyte benötigt man in der Regel Gleichungen mit weiteren, stoffabhängigen Parametern, z. B. die Bromley-Gleichung oder die von Kenneth Pitzer entwickelten Pitzer-Gleichungen.
Einzelnachweise
- Cecil Whitfield Davies: 397. The extent of dissociation of salts in water. Part VIII. An equation for the mean ionic activity coefficient of an electrolyte in water, and a revision of the dissociation constants of some sulphates. In: The Chemical Society (Hrsg.): Journal of the Chemical Society (Resumed). 1938, S. 2093–2098, doi:10.1039/JR9380002093.
- Cecil Whitfield Davies Davies, Ion Association. London: Butterworths 1962. Seiten 37–53.
- 6.6.A.3 Davies Equation in: James W. Murray, Chapter 6 Activity Scales and Activity Corrections
- Rudolf Brdicka, Grundlagen der Physikalischen Chemie, 15. Bearbeitete Auflage, Bearbeitet von Jiri Dvorak, Deutscher Verlag der Wissenschaften, Berlin 1990, Seite 583.
- Stefan Doeller: Calculation of Proton Activity in Aqueous Protolyte Solutions. In: Analytica Chimica Acta. Band 115, 15. März 1980, S. 261–268, doi:10.1016/S0003-2670(01)93164-2 (sciencedirect.com [abgerufen am 5. Juni 2016]).
- Edward A. Guggenheim: L. The specific thermodynamic properties of aqueous solutions of strong electrolytes. In: The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. Series 7. Band 19, Nr. 127. Taylor & Francis, 1935, ISSN 1941-5990, S. 588–643, doi:10.1080/14786443508561403 (englisch).
- Edward A. Guggenheim: XXVII. Specific thermodynamic properties of aqueous solutions of uni-univalent electrolytes. In: The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science Series 7. Band 22, Nr. 146. Taylor & Francis, 1936, ISSN 1941-5990, S. 322–336, doi:10.1080/14786443608561690 (englisch, tandfonline.com [PDF]).
- Fragen und Antworten zum Geochemie-Programm PHREEQC
- Hans-Peter Blume, Gerhard W. Brümmer, Rainer Horn, Ellen Kandeler, Ingrid Kögel-Knabner, Ruben Kretzschmar, Karl Stahr, Berndt-Michael Wilke: Scheffer/Schachtschabel: Lehrbuch der Bodenkunde. 16. Auflage. Springer-Verlag, Spektrum Akademischer Verlag, Heidelberg 2010, ISBN 978-3-8274-1444-1, 5.3.1. Ionenstärke, Konzentration und Aktivität, S. 126 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 5. Juni 2016]).
- Donald L. Sparks: Soil Physical Chemistry. Second Edition. CRC Press, Boca Raton, Boston, London New York 1998, ISBN 0-87371-883-6, Chapter 3, Thermodynamics of the Soil Solution, 3. Davies equation, S. 113 (englisch, Vorschau bei Google Books [abgerufen am 26. Mai 2016]).
- Harald Kalka: 2.5 Nichtideale Lösungen und Aktivitätsmodelle. (pdf; 1,4 MB) In: aquaC – aquatische Chemie, Bedienungsanleitung zum Programm. UIT GmbH,, August 2003, S. 12–13, abgerufen am 5. Juni 2016.
- Harald Kalka: Aktivitätskoeffizient und Aktivitätsmodelle. In: Wasserchemie. Abgerufen am 5. Juni 2016.