DLVO-Theorie
Die DLVO-Theorie (benannt nach Boris Derjaguin, Lew Dawidowitsch Landau, Evert Verwey, Theodoor Overbeek) ist eine theoretische Beschreibung, die sich mit der Stabilität kolloidaler Systeme auf der Grundlage von attraktiven und repulsiven, zum Beispiel sterischen, elektrostatischen oder van-der-Waalsschen Wechselwirkungen zwischen den dispergierten Teilchen beschäftigt.
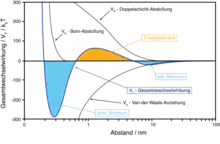
Die Oberflächen der kolloiden Teilchen werden als Kondensatorplatten verstanden, an deren Oberflächen sich in einer Elektrolytlösung elektrochemische Doppelschichten ausbilden. Nähern sich die Teilchen an, so überlappen sich die Doppelschichten. Die daraus resultierenden repulsiven Kräfte haben eine größere Reichweite als die anziehenden Van-der-Waals-Kräfte. Ungeschützte Dispersionen werden so elektrostatisch stabilisiert.
Für zwei Kugeln mit dem Radius und einer konstanten Oberflächenladung bei einem Schwerpunktsabstand in einem Fluidum mit einer dielektrischen Konstante und einer Konzentration an monovalenten Ionen ergibt sich das elektrostatische Potential als die Coulombkraft oder Yukawa-Abstoßung
mit als der Bjerrum-Länge, als dem Debye-Hückel-Abstand, der definiert ist als und mit als thermischer Energie bei der absoluten Temperatur .
Geschichte
1923 stellten Peter Debye und Erich Hückel zum ersten Mal ihre Theorie zur Beschreibung der Verteilung von Ionenladungen in einer ionischen Lösung vor.[1] Der grundsätzliche Gedanke, die linearisierte Debye-Hückel-Theorie auf kolloidale Dispersion anzuwenden, kam von Levine und Dube,[2][3] die herausfanden, dass geladene kolloidale Partikel eine starke Abstoßung bei geringem Abstand und eine schwache Anziehung bei weitem Abstand erfahren. Jedoch konnte diese Theorie nicht erklären, warum kolloidale Dispersionen in Lösungen mit hoher Ionenkonzentration aggregieren. 1941 präsentierten Derjaguin und Landau eine neue Theorie über die Stabilität von kolloidalen Dispersionen, bei der die stark anziehend wirkenden van der Waalschen Kräfte bei geringem Abstand überlagert werden von den elektrostatischen Kräften, die stärker bei großer Distanz wirken.[4] Sieben Jahre später stellten Verwey und Overbeek[5] unabhängig voneinander eine Lösung vor, wie die Instabilitäten mit der so genannten DLVO-Theorie beschrieben werden können.[6]
Herleitung der DLVO-Theorie
Die DLVO-Theorie kombiniert die Kräfte resultierend aus den van-der-Waalsschen Wechselwirkungen und elektrochemische Doppelschicht. Zur Herleitung müssen unterschiedliche Bedingungen und unterschiedliche Gleichungen berücksichtigt werden.[7] Jedoch kann die Herleitung unter Berücksichtigung einiger recht üblicher Annahmen deutlich vereinfacht werden und einfach über die Kombination von zwei separat hergeleiteten Theorien erstellt werden.
Van-der-Waalssche Anziehung
Van-der-Waals-Kräfte ist der Überbegriff für alle Dipol-Dipol-Wechselwirkungen. Unter der Annahme, dass das Potential zwischen zwei Atomen oder kleinen Molekülen nur anziehend und von der Form , mit als eine Konstante für die Interaktionsenergie und für die Van-der-Waalschen Kräfte.[8] Und weiterhin mit der Annahme, dass die Interaktionsenergie zwischen einem Molekül und einer planaren Fläche sich aus der Summe der Interaktionsenergien aller Moleküle aus der Grenzfläche mit dem Molekül ergibt, kann die gesamte Interaktionsenergie für ein Molekül in Abhängigkeit von der Distanz von der Oberfläche wie folgt angegeben werden
mit
- der Interaktionsenergie zwischen dem Molekül und der Oberfläche ,
- der Anzahldichte der Oberfläche ,
- dem Abstand senkrecht zur Oberfläche mit
- dem Molekül bei und
- der Oberfläche bei sowie
- dem Abstand parallel zur Oberfläche .
Damit kann die Interaktionsenergie für große Kugeln mit dem Radius R zu einer planaren Fläche wie folgt berechnet werden
mit
- der Interaktionsenergie zwischen der Kugel und der planaren Fläche und
- der Anzahldichte der Kugel .
Vereinfacht ist die Hamaker-Konstante A definiert als
womit sich folgende Gleichung ergibt
Mit einer ähnlichen Methode und mit der Derjaguin-Approximation[9] können die Van-der-Waals Wechselwirkungen zwischen Partikel und unterschiedlichen Geometrien wie folgt berechnet werden
- Zwei Kugeln:
- Kugel-Fläche:
- Zwei Flächen: pro Flächeneinheit
Elektrochemische Doppelschicht
Es gibt zwei Möglichkeiten, die Dicke der elektrochemischen Doppelschicht herabzusetzen. Zum einen kann die Abschirmung der Oberflächenladung durch Elektrolytzugabe verstärkt und die Schicht dadurch komprimiert werden. Zum anderen kann das Oberflächenpotential durch spezifische Ionenadsorption vermindert werden.
Wird der Teilchenabstand so weit verringert, dass die attraktiven Wechselwirkungen dominant über die Abstoßungskräfte werden, tritt eine Koagulation der Teilchen ein.
Literatur
- Peter Debye, Erich Hückel: The theory of electrolytes. I. Lowering of freezing point and related phenomena. In: Physikalische Zeitschrift. Band 24, 1923, S. 185–206.
- S. Levine: Problems of stability in hydrophobic colloidal solutions I. On the interaction of two colloidal metallic particles. General discussion and applications. In: Proceedings of the Royal Society of London A. Band 170, Nr. 941, 1939, S. 145–164, JSTOR:97213.
- S. Levine, G. P. Dube: Interaction between two hydrophobic colloidal particles, using the approximate Debye-Hückel theory. I. General properties. In: Transactions of the Faraday Society. Band 35, 1939, S. 1125–1140, doi:10.1039/TF9393501125.
- B. Derjaguin, L. Landau: Theory of the stability of strongly charged lyophobic sols and of the adhesion of strongly charged particles in solutions of electrolytes. In: Acta Physico Chemica URSS. Band 14, 1941, S. 30–59, doi:10.1016/0079-6816(93)90013-L.
- E. J. W. Verwey, J. Th. G. Overbeek: Theory of the stability of lyophobic colloids. Elsevier, New York 1948, OCLC 2313484.
- W. B. Russel, D. A. Saville, W. R. Schowalter: Colloidal Dispersions. Cambridge University Press, New York 1989, ISBN 978-0-521-34188-2.
- M. Elimelech, J. Gregory, X. Jia, R. A. Williams: Particle Deposition and Aggregation Measurement. Modelling and Simulation. Boston 1995, ISBN 978-0-7506-0743-8.
- F. London: The general theory of molecular forces. In: Transactions of the Faraday Society. Band 33, 1937, ISSN 0014-7672, S. 8–26, doi:10.1039/TF937330008B.
- B. Derjaguin: Untersuchungen über die Reibung und Adhäsion, IV. In: Kolloid-Zeitschrift. Band 69, Nr. 2, 1934, ISSN 1435-1536, S. 155–164, doi:10.1007/BF01433225.