Curtin-Hammett-Prinzip
Das Curtin-Hammett-Prinzip ist ein von David Yarrow Curtin und Louis Plack Hammett aufgestelltes Prinzip in der chemischen Kinetik. Es besagt, dass bei einer chemischen Reaktion die Lage eines vorgelagerten schnellen Gleichgewichts die Produktbildung nicht beeinflusst. Stehen zwei reaktive Zwischenstufen A und B miteinander im Gleichgewicht (zum Beispiel Konformere) und kann eine dieser Zwischenstufen (A) in ein Produkt C bzw. die andere (B) in D übergehen, so hängt das Produktverhältnis nur von der freien Energie des Übergangszustandes zum jeweiligen Produkt, jedoch nicht von der Gleichgewichtskonstante K zwischen A und B ab. A und B stehen im dynamischen Gleichgewicht, A wandelt sich irreversibel in C, B irreversibel in D um.[1][2]
![]()
K ist die Gleichgewichtskonstante zwischen A und B, k1 und k2 sind die Geschwindigkeitskonstanten für die Bildung von C bzw. D. Ist die Reaktionsgeschwindigkeit der Umwandlung von A in B und umgekehrt größer als k1 oder k2, besagt das Curtin-Hammett-Prinzip, dass das Produktverhältnis C:D nicht von K abhängt, sondern von den relativen Energien der Übergangszustände.[1][2]
Energieschema
Das Energieschema lässt sich folgendermaßen darstellen:
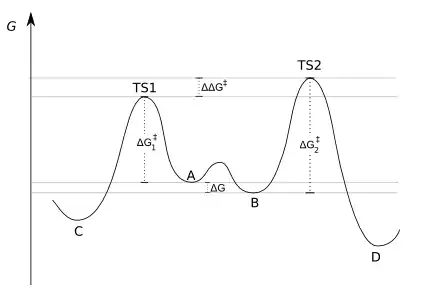
Das Produktverhältnis hängt nur von ΔΔG‡ ab (siehe Schema): C ist das Hauptprodukt, denn die Energie des Übergangzustands TS1 ist niedriger als die des Zustands TS2. Dabei spielt es keine Rolle, ob im Gleichgewicht mehr von A oder B vorliegt.[2]
Einzelnachweise
- J. Clayden, N. Greeves, S. G. Warren: Organische Chemie. 2. Auflage. Springer, Berlin 2013, S. 944, ISBN 978-3-642-34715-3.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, S. 415–418 ISBN 3-8274-1579-9.