Biomassekonversion
Biomassekonversion oder Biomasseumwandlung bezeichnet die Verarbeitung und Veredlung von Biomasse zu energetisch und/oder stofflich nutzbaren Produkten wie beispielsweise Brennstoffen oder Chemikalien.[1]
.jpg.webp)
Je nach Art der Konversion wird zwischen thermisch-chemischer Konversion, biochemischer Konversion und physikalisch-chemischer Konversion unterschieden.
Allgemeines
| Produkt | Thermo- chemisch | Bio- chemisch | Physikalisch- chemisch |
|---|---|---|---|
| Kraftstoff- Additive | |||
| Holzkohle | – | – | |
| Dieselartige Kraftstoffe | – | – | |
| BtL-Kraftstoff | – | – | |
| Schweröl | – | – | |
| Benzin | – | – | |
| Wasserstoff | – | ||
| Methan | – | ||
| Aceton | – | – | |
| Methanol | – | – | |
| Ethanol | |||
| Butanol | – | – | |
| Aktivkohle | – | – | |
| Dünger | – | ||
| Feinchemikalien |
Im Zuge der Abkehr von fossilen Energieträgern spielen nachwachsende Rohstoffe (Biomasse) eine wichtige Rolle. Diese können sowohl stofflich als auch energetisch genutzt werden, allerdings muss die zugrundeliegende Biomasse für die energetische Nutzung oft zunächst in praktikablere Sekundärenergieträger oder für die stoffliche Nutzung über verschiedene Plattformchemikalien zu Endprodukten verarbeitet werden. Für diese Umwandlungen gibt es zahlreiche technische Möglichkeiten, die sich grob in drei Oberkategorien einordnen lassen, in thermo-chemische, biochemische und physikalisch-chemische Konversionen.[3] Dabei ist zu beachten, dass nicht durch alle Konversionsarten die gleichen Produkte erhalten werden können.
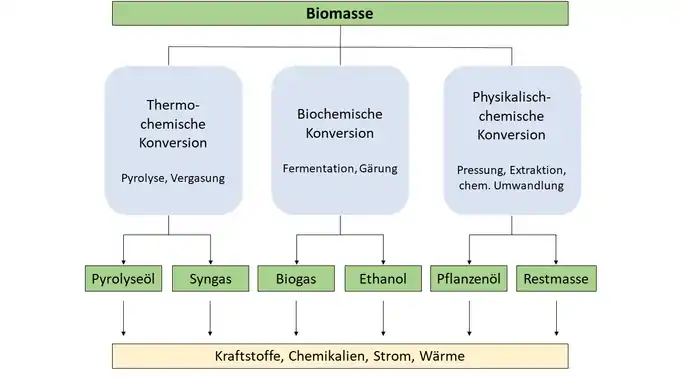
Der Begriff steht oft im Kontext mit dem Konzept der Bioraffinerie, welche in Zukunft als Ort für die verschiedenen Konversionen gesehen wird.
Thermo-chemische Umwandlungsmethoden
Zu den thermo-chemischen Umwandlungsmethoden gehören alle Verfahren, die hauptsächlich Wärme zur Biomassekonversion nutzen. Dazu zählen zum Beispiel alle Pyrolysevarianten, die Biomassevergasung, Torrefizierung aber auch die direkt Verbrennung von Biomasse.[3] Je nach Verfahren kann das Ziel die Herstellung von Plattformchemikalien zur stofflichen Nutzung sein oder die Herstellung von festen, flüssigen oder gasförmigen Brennstoffen zur energetischen Nutzung. Diese Umwandlungsmethoden sind im vergleich zu biochemischen Methoden schnell und liefern eher komplexe Produktgemische.[2]
Bei der vollständigen thermochemischen Umwandlung lassen sich verschiedene Phasen unterscheiden, in denen verschiedene Vorgänge ablaufen.[4] Diese werden je nach Temperatur und Menge des vorhandenen Sauerstoffs (Verbrennungsluftverhältnis λ) nacheinander durchlaufen, allerdings lassen sie sich nicht vollständig voneinander abtrennen, sondern es bestehen fließende Übergänge. Bei der Verbrennung werden alle Phasen am gleichen Ort parallel unter Anwesenheit von Sauerstoff durchlaufen. Durch das Einstellen der entsprechenden Bedingungen kann jedoch auch gezielt eine Phase angestrebt werden. Da dies technisch auch gemacht wird, überschneiden sich die Namen der Phasen teilweise mit den Namen technischer Prozesse.[4]
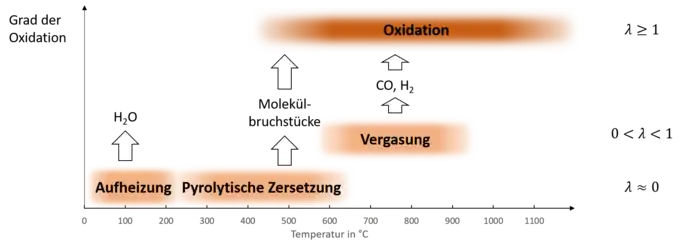
Aufheizung
Bei der Aufheizung wird die Masse erwärmt und dadurch getrocknet, da gespeichertes Wasser verdampft. Diese Phase ist in der Regel endotherm und der Brennstoff selbst erwärmt sich erst langsam, da das verdunstende Wasser diesem Energie entzieht. In dieser Phase laufen noch keine Oxidationsprozesse ab. Von Aufheizung wird in der Regel bei Temperaturen zwischen 100 und 200 °C gesprochen, allerdings ist der Übergang zur folgenden Phase ist fließend, da auch hier schon erste Zersetzungsprozesse ablaufen können.[4]

Pyrolytische Zersetzung
Diese Phase wird ca. von 150 bis 700 °C und ohne externen Sauerstoff erreicht. Durch die zugeführte Energie zersetzt sich das getrocknete Material, da auf Teilchenebene Bindungen aufgebrochen werden. Dabei entstehen zahlreiche verschiedene Produkte in allen Aggregatzuständen. Die Anteile der festen (Pyrolysekoks), flüssigen (Pyrolyseöl) und gasförmigen Produkte (Brenngas) können je nach genaueren Bedingungen variieren. Obwohl kein externer Sauerstoff vorhanden ist können trotzdem sauerstoffinduzierte Reaktionen ablaufen, da Sauerstoffatome in der Biomasse vorhanden sind. Da die entstehenden Verbindungen oft reaktiv sind, können besonders bei längerer Dauer und höherer Temperatur noch Folgereaktionen auftreten. Die pyrolytische Zersetzung ist wie das Aufheizen ein endothermer Prozess.[4]
Pyrolyseprozesse (kurz: Pyrolysen) sind Prozesse, die auf dieser Stufe angehalten werden.
Vergasung
Bei der Vergasung werden die Produkte der pyrolytischen Zersetzung noch stärker aufgeheizt (ca. 700 bis 1000 °C) und das feste Pyrolysekoks reagiert mit einem externen Vergasungsmittel, das Sauerstoff oder Sauerstoffatome enthält (z. B. Luft, Sauerstoff oder Wasser) zu brennbaren Gasen wie Kohlenmonoxid und Wasserstoff. Dabei steigt der Oxidationsgrad weiter an. Auch in dieser Phase laufen je nach Vergasungsmedium und Temperatur zahlreiche verschiedene Reaktionen ab. Die Vergasung ist wie die vorgegangenen Schritte endotherm.[4]
Vergasungsprozesse wie die Biomassevergasung sind Prozesse, die auf dieser Stufe angehalten werden.
Oxidation
Bei der Oxidation werden alle noch oxidierbaren Produkte aus den vorherigen Phasen durch Sauerstoff vollständig oxidiert, wobei Wasser und Kohlendioxid entstehen. Dazu muss genügend Sauerstoff vorhanden sein. Damit die Oxidation gut ablaufen kann, ist wichtig, dass die Temperatur hoch genug ist, dass die brennbaren Gase und der Sauerstoff laufend durchmischt werden und dass genügend Zeit vorhanden ist. Diese Phase ist stark exotherm und kann in einem laufenden Verbrennungsprozess so Energie für die endothermen Phasen bereitstellen.[4]

Biochemische Umwandlungsmethoden
Zu den biochemischen Umwandlungsmethoden gehören alle Arten von Fermentationen und Gärungen, also beispielsweise die Herstellung Biogas, die Herstellung von Alkohol durch alkoholische Gärung aber auch die Kompostierung.[3] Diese Methoden sind im Vergleich zu thermo-chemischen Methoden langwieriger, allerdings werden gezieltere Produkte erhalten.[2]
Physikalisch-chemische Umwandlungsmethoden
Zu den physikalisch-chemischen Umwandlungsmethoden gehören alle Prozesse, die von Ölpflanzen ausgehen. Aus diesen können durch Pressen und/oder Extraktion Pflanzenöle gewonnen werden, wobei die zurückbleibende Masse (Presskuchen oder Extraktionsschrot) stofflich oder als Tierfutter verwendet werden kann. Die Pflanzenöle können energetisch als Brennstoffe in Verbrennungsmotoren genutzt werden, allerdings ist dafür je nach Motor eine weitere Verarbeitung (z. B. Umesterung) nötig.[3]
Einzelnachweise
- Biomassekonversion. Institut für Energie- und Umweltforschung Heidelberg, abgerufen am 30. Oktober 2019.
- Tony Bridgwater: Review Biomass for energy. In: Journal of the Science of Food and Agriculture. Band 86, 2006, S. 1755–1768, doi:10.1002/jsfa.2605.
- Martin Kaltschmitt: Biomasse als nachwachsender Energieträger. In: Martin Kaltschmitt, Hans Hartmann & Hermann Hofbauer (Hrsg.): Energie aus Biomasse – Grundlagen, Techniken und Verfahren. 3. aktualisierte und erweiterte Auflage. Springer Vieweg, Berlin 2016, ISBN 978-3-662-47437-2, 1.1, S. 1–8.
- Veronika Wilk, Hermann Hofbauer & Martin Kaltschmitt: Thermo-chemische Umwandlungsprozesse. In: Martin Kaltschmitt, Hans Hartmann & Hermann Hofbauer (Hrsg.): Energie aus Biomasse – Grundlagen, Techniken und Verfahren. 3. aktualisierte und erweiterte Auflage. Springer Vieweg, Berlin 2016, ISBN 978-3-662-47437-2, 11.2, S. 646–683.