Verfahren nach Victor Meyer
Über das Verfahren nach Victor Meyer lässt sich die molare Masse einer verdampfbaren Flüssigkeit bestimmen. Die Methode hat heute allerdings eher einen didaktischen Nutzen für die Chemikerausbildung bzw. den Chemieunterricht.
Grundlagen
Eine bestimmte Menge einer Flüssigkeit wird verdampft. Unter Anwendung der allgemeinen Gasgleichung für ideale Gase lässt sich über das Volumen der verdampften Flüssigkeit die molare Masse berechnen.
Löst man diese Gleichung nach der molaren Masse M auf, so gilt:
Hierbei ist m die eingewogene Masse der Substanz, R die allgemeine Gaskonstante, T die Temperatur des Gasvolumens, p der Druck des Gasvolumens und V das Volumen des Gases.
Mit ist die Temperatur T in Kelvin, der Druck p in Pascal und das Volumen V in m3 anzugeben. Die Masse m kann in g oder kg angegeben werden, dementsprechend ist die Einheit für die molare Masse M g/mol oder kg/mol.
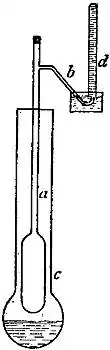
Verfahren
Die Apparatur nach Victor Meyer besteht aus einem schmalen Verdampfungsrohr, dessen unten erweiterter Teil sich in einem Heizbad (Wasser für Stoffe, die unter 100 °C sieden) befindet. Das Verdampfungsrohr ist außerdem von einem Heizmantel umgeben. Oben ist die Apparatur an eine Vorrichtung (Gasbürette mit Niveauausgleich oder Kolbenprober) zum Auffangen des Gases angeschlossen. Die zu verdampfende Substanz wird in einem Substanzgläschen genau abgewogen in das Verdampfungsrohr gebracht, wobei die Apparatur danach sofort wieder verschlossen wird. Das Volumen der verdampften Substanz verdrängt nun ein entsprechendes Luftvolumen, das mit Hilfe der Auffangvorrichtung bestimmt wird. Die zu bestimmende Temperatur ist die des aufgefangenen Luftvolumens, in der Regel die Umgebungstemperatur, und nicht die im Verdampfungsrohr. Der Druck ist nach Druckausgleich der herrschende Luftdruck.
In einer vereinfachten Methode für leicht verdampfbare Flüssigkeiten, die schon bei Raumtemperatur verdunsten, wie z. B. Diethylether, wird das Heizbad weggelassen und statt des langen Verdampfungsrohres ein großer Kolben verwendet.
In einer anderen Variante kann man einen elektrisch beheizbaren Kolbenprober verwenden. Die Substanz wird hierbei genau abgewogen in das Innere des Kolbenprobers gebracht und verdampft. Zur Auswertung muss man von der Volumenzunahme die Volumenzunahme der vorher im Kolbenprober vorhandenen Luft abziehen. Die Temperatur wird im Kolbenprober gemessen.[1]
Literatur
- Gottwald/Puff: Physikalisch-chemisches Praktikum, VCH Weinheim 1987, S. 29 ff, ISBN 3-527-26498-1
- H. Böhland: Chemische Schulexperimente Band 5: Allgemeine, physikalische und analytische Chemie, Verlag Harri Deutsch Thun – Frankfurt 1979, S. 25 ff, ISBN 3-87144-358-1
Einzelnachweise
- Böse/Schmidt: Quantitative Versuche mit dem Kolbenprober, Diesterweg Salle 1972, S. 25, ISBN 3-425-05076-1