Pigmentierte villonoduläre Synovialitis
Die pigmentierte villonoduläre Synovialitis ist der veraltete und im deutschsprachigen Raum weiter oft verwendete Begriff für den tenosynovialen Riesenzelltumor, eine seltene Erkrankung der Schleimhaut in Gelenken oder Sehnenscheiden. Gebräuchliche Abkürzungen sind PVS und PVNS. Mit dem Riesenzelltumor des Knochens sollte diese Erkrankung nicht verwechselt werden.
| Klassifikation nach ICD-10 | |
|---|---|
| M12.2 | Villonoduläre Synovitis (pigmentiert) |
| ICD-10 online (WHO-Version 2019) | |
Ursachen
Bei dem tenosynovialen Riesenzelltumor handelt es sich um einen niedrig-malignen Tumor aus der Gruppe der Weichteiltumoren. In der Regel findet sich eine Überexpression des Wachstumsfaktors CSF1, die oft durch eine für dieses Sarkom typische t(1;2) Translokation ausgelöst wird. Dabei werden Teile des ersten und zweiten Chromosoms derart ausgetauscht, dass das Gen für CSF1 im Abschnitt 1p13 des ersten Chromosoms mit einem Gen des Kollagens Typ VI (COL6A3) im Abschnitt 2q35 des zweiten Chromosoms verbunden wird.[1]
Diese Translokation entsteht spontan in Synovialzellen, die den Tumor bilden und Histiozyten, Hämosiderin-beladene Makrophagen und andere Entzündungszellen anziehen, die für die oftmals rötlich-braune Pigmentierung dieser Synovialtumoren verantwortlich sind. Neben der umschriebenen (nodulären) Form gibt es diffuse Formen mit Ausbreitung im gesamten Gelenk oder in der gesamten Sehnenscheide.
Häufigkeit
In der Literatur wird das Auftreten der PVS mit 1,8 pro Million angegeben. Haupterkrankungsalter ist das 3. und 4. Lebensjahrzehnt. Das meistbetroffene Gelenk ist das Knie.
Symptome
Die betroffenen Gelenke oder Sehnenscheiden sind geschwollen – einerseits durch die verdickte Schleimhaut, anderseits aber auch häufig durch einen entzündlichen Gelenkerguss. Dieser ist oft blutig. Manchmal erfolgen vor Diagnosestellung wiederholte Punktionen. Der Befall mehrerer Gelenke oder Lokalisationen ist möglich aber eine absolute Rarität. In diesen Fällen muss primär an den seltenen bösartigen (malignen) Riesenzelltumor der Sehnenscheiden gedacht werden, der selbst jedoch eine umstrittene Entität darstellt.
Diagnostik
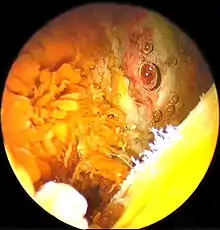
Nicht selten wird die PVS zufällig im Rahmen einer Gelenkspiegelung entdeckt. Es finden sich bei der diffusen Formen bräunlich-gelbe Schleimhautzotten. Bei der lokalisierten Erkrankung liegt ein umschriebener Tumor vor.
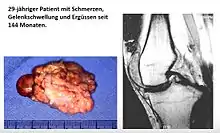
Gesichert wird die Diagnose durch die mikroskopische Untersuchung. Auch die Magnetresonanztomographie zeigt charakteristische Befunde.
Therapie
Bei entsprechenden Beschwerden ist die Tumorentfernung (nodulär) oder, bei diffusen Formen, die Entfernung der Gelenkschleimhaut (Synovektomie) erforderlich. Auch eine Strahlentherapie oder eine Radiosynoviorthese (begleitend zu einer Operation) kann erfolgreich sein. Cortison-Injektionen oder die Gabe nichtsteroidaler Antirheumatika sind dagegen nicht krankheitsbezogen, allenfalls symptomatisch wirksam.
Oftmals ist die vollständige Entfernung des Tumors schwierig, besonders bei diffusen Formen. Dann bleibt als therapeutische Alternative manchmal nur eine Endoprothese.
Zellen der PVS zeigen eine Überexpression des "Colony stimulating factor-1" (CSF1). Nur einige Zellen der Läsion zeigen dies, es kommt jedoch zur Anziehung von Entzündungszellen, die dann wiederum verstärkt CSF1-Rezeptoren exprimieren. Imatinib, ein Tyrosinkinase-Inhibitor, der bei bestimmten Krebserkrankungen sehr erfolgreich eingesetzt wird, blockiert diese CSF1-Rezeptoren. Entsprechend versucht man den Einsatz auch bei der PVS. Fünf von 27 Patienten zeigten eine Tumorregression, einer komplett, 4 partiell. 20 der 27 hatten kein weiteres Voranschreiten der Erkrankung.[2] Andere Autoren verwandten einen Antikörper gegen bestimmte Gefäßwandanteile, den sie direkt in das Gelenk injizierten (Bevacizumab, ein humanisierter monoklonaler Antikörper gegen den Vascular Endothelial Growth Factor (VEGF)). In einem Falle eines multiplen Rezidivs im Kniegelenk erzielten sie damit eine deutliche klinische und radiologische Besserung.[3]
In einer amerikanischen Phase-I-Studie wurde 2015 an 41 Patienten eine Dosis-Eskalationsstudie mit einem speziell entwickelten selektiven CSF1-Rezeptor-Inhibitor (PLX3397) durchgeführt; in einer nachfolgenden Phase-II-Studie an 23 Patienten zeigte sich eine Ansprechrate (Response rate) von 52 %.[4] Dieser Rezeptorantagonist wurde aufgrund einer kristallographischen Strukturanalyse derart entwickelt, dass er wie Imatinib in der katalytischen Tasche des Proteins an Phenylalanin in Position 797 (phe797) bindet, aber anders als Imatinib gleichzeitig die Juxtamembran-Domäne bindet und so den Rezeptor in der geschlossenen inaktiven Form stabilisiert.[5] Eine randomisierte Studie mit PLX3397 vs. Placebo findet statt. Alle lokalen Maßnahmen, insbesondere die kompetent durchgeführte Tumorentfernung, sollten ausgeschöpft sein. Wie sich die Erkrankung nach Absetzen des Antikörpers verhält, ist noch unklar.
Literatur
- tumororthopaedie.org
- Carl Joachim Wirth: Praxis der Orthopädie. Georg Thieme Verlag, Stuttgart/ New York 2001, ISBN 3-13-125683-4.
- H. R. Dürr u. a.: Die pigmentierte villonoduläre Synovitis (PVS). (PDF; 399 kB)
Einzelnachweise
- R. B. West, B. P. Rubin, M. A. Miller, S. Subramanian, G. Kaygusuz, K. Montgomery, S. Zhu, R. J. Marinelli, A. De Luca, E. Downs-Kelly, J. R. Goldblum, C. L. Corless, P. O. Brown, C. B. Gilks, T. O. Nielsen, D. Huntsman, M. van de Rijn: A landscape effect in tenosynovial giant-cell tumor from activation of CSF1 expression by a translocation in a minority of tumor cells. In: Proceedings of the National Academy of Sciences. Band 103, Nummer 3, Januar 2006, S. 690–695, doi:10.1073/pnas.0507321103. PMID 16407111, PMC 1325107 (freier Volltext).
- P. A. Cassier u. a.: Efficacy of imatinib mesylate for the treatment of locally advanced and/or metastatic tenosynovial giant cell tumor/pigmented villonodular synovitis. In: Cancer. 118(6), 15. Mar 2012, S. 1649–1655.
- M. J. Nissen u. a.: Efficacy of intra-articular bevacizumab for relapsing diffuse-type giant cell tumour. In: Ann Rheum Dis. 73(5), Mai 2014, S. 947–948.
- W. D. Tap, Z. A. Wainberg, S. P. Anthony, P. N. Ibrahim, C. Zhang, J. H. Healey, B. Chmielowski, A. P. Staddon, A. L. Cohn, G. I. Shapiro, V. L. Keedy, A. S. Singh, I. Puzanov, E. L. Kwak, A. J. Wagner, D. D. Von Hoff, G. J. Weiss, R. K. Ramanathan, J. Zhang, G. Habets, Y. Zhang, E. A. Burton, G. Visor, L. Sanftner, P. Severson, H. Nguyen, M. J. Kim, A. Marimuthu, G. Tsang, R. Shellooe, C. Gee, B. L. West, P. Hirth, K. Nolop, M. van de Rijn, H. H. Hsu, C. Peterfy, P. S. Lin, S. Tong-Starksen, G. Bollag: Structure-Guided Blockade of CSF1R Kinase in Tenosynovial Giant-Cell Tumor. In: N Engl J Med. 373(5), 30. Jul 2015, S. 428–437. (PDF)
- Bruce Chabner, Victoria Richon: Structural Approaches to Cancer Drug Development. In: New England Journal of Medicine. Band 373, Ausgabe 5, 30. Juli 2015, S. 402–403, doi:10.1056/NEJMp1503567