Nazarov-Cyclisierung
Die Nazarov-Cyclisierung, auch Nazarov-Reaktion genannt, ist eine Namensreaktion der organischen Chemie und wurde in den Vierzigerjahren durch den russischen Chemiker Ivan Nikolaevich Nazarov (1906–1957) entdeckt.[1] Bei der Reaktion handelt es sich um eine Synthesereaktion für Cyclopentenone aus Divinylketonen und deren Präkursoren.[2][3]
| Edukt |
|---|
 Divinylketon R1 = H, Alkyl, Aryl R2 = H, Alkyl, Aryl |
Unter dem Begriff der Nazarov-Cyclisierung werden weitere Reaktionen mit anderen Substraten aber ähnlichem Reaktionsmechanismus zusammengefasst.
Übersichtsreaktion
Bei der von Nazarov ursprünglich beschriebenen Cyclisierung werden stöchiometrische Mengen einer Lewis-Säure zur Aktivierung des Divinylketons verwendet.[1][2][3] Die folgende Übersicht zeigt eine Variante mit Wasserstoff als Substituent (R1 = H und R2 = H):
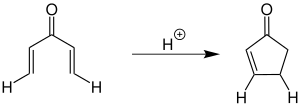
Neben Wasserstoff können eine Vielzahl weiterer Organylgruppen verwendet werden. Sowohl für R1 als auch R2 sind Alkyl- und Arylgruppen möglich.[3][4]
Werden bei der Nazarov-Cyclisierung unsymmetrische Divinylketone (R1 ≠ R2) eingesetzt, so läuft die Reaktion nach folgendem Reaktionsschema ab:
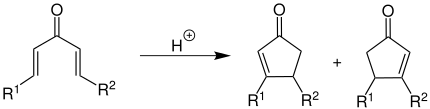
Dabei entsteht ein Gemisch zweier regioisomerer α,β-ungesättigter Ketone.
Mechanismus
Der Mechanismus der Nazarov-Cyclisierung ist sehr gut erforscht. Es handelt sich dabei im Wesentlichen um einen elektrocyclischen Mechanismus mit konrotatorischem Ringschluss.[5][6]

Im ersten Reaktionsschritt wird das Divinylketon 1 unter dem Einfluss einer Säure zum Hydroxypentadienylkation 2 protoniert. Anschließend reagiert Substanz 2 mittels Ringschluss zum Cyclopentenylkation 3. Durch anschließende Deprotonierung des Kations 3 bildet sich zuerst das Enol 4, welches durch Keto-Enol-Tautomerie dann zum α,β-ungesättigten Keton 5 reagiert.
Die Entstehung eines Produktgemisches bei der Umsetzung von unsymmetrischen Divinylketonen ist auf folgende mesomere Grenzformeln des im Mechanismus auftretenden Cyclopentenylkations zurückzuführen:[5]

Beide mesomeren Grenzformeln können, wie im Mechanismus gezeigt, deprotoniert werden. Folglich entstehen zwei Reaktionsprodukte.
Anwendung
Die bei der Reaktion entstehenden Produktgemische stellen einen großen Nachteil bei dem Einsatz in der chemischen Industrie dar. Dieser wird durch den Einsatz folgender Trimethylsilyl-substituierten Carbonylverbindungen verhindert:[5]

Dieses Verfahren wurde erstmals von dem Chemiker Scott Denmark publiziert.[5] Da sich Divinylketone mit verschiedensten Substituenten relativ leicht synthetisieren lassen, findet die Nazarov-Cyclisierung diverse Anwendungsmöglichkeiten. Vor allem die Verwendung silylierter Carbonylverbindungen spielt eine wichtige Rolle bei der Synthese cyclopentanoider Systeme in der Naturstoffchemie.[5][6]
Literatur
- Tülay A Ateşin: Nazarov Cyclization Reaction. Challenges and Opportunities. In: Organic Chemistry. Current Research. Band 03, Nr. 01, 13. Januar 2014, doi:10.4172/2161-0401.1000e130.
- Christiane Santelli-Rouvier, Maurice Santelli: The Nazarov Cyclisation. In: Synthesis. Band 1983, Nr. 06, 1983, S. 429–442, doi:10.1055/s-1983-30367.
Einzelnachweise
- I. N. Nazarov, I. I. Zaretskaya: Derivatives of acetylene. XXVII. Hydration of divinylacetylene. In: Bull. acad. sci. U.R.S.S., Classe sci. chim. 1942, S. 200–209.
- I. N. Nazarov, I.I. Zaretskaya: Structure of products of hydration of divinylethynyl hydrocarbons. In: Zh. Obshch. Khim. 27, 1957, S. 693–713.
- I. N. Nazarov, I. I. Zaretskaya, T. I. Sorkina: Cyclopentanolones from the cyclization of divinyl ketones. In: Zh. Obshch. Khim. 30, 1960, S. 746–754.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2011–2015, doi:10.1002/9780470638859.
- Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. Vieweg+Teubner Verlag, Wiesbaden 2006, ISBN 3-8351-0091-2, Nazarov-Cyclisierung, S. 240–242, hier S. 230–232, doi:10.1007/978-3-322-94726-0_73 (Erstausgabe: 1994).
- László Kürti, Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis. Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 304–305, ISBN 978-0-12-429785-2.