Mukaiyama-Michael-Reaktion
Die Mukaiyama-Michael-Reaktion, auch Mukaiyama-Michael-Addition genannt, ist eine Namensreaktion der organischen Chemie und wurde erstmals 1974 durch den japanischen Chemiker Teruaki Mukaiyama publiziert.[1] Dabei werden Enol-Silane an α,β-ungesättigte Carbonylverbindungen addiert.
Die Reaktion hängt eng mit der Mukaiyama-Aldolreaktion sowie der Michael-Addition zusammen.
Übersichtsreaktion
Die Mukaiyama-Michael-Reaktion lässt sich mit einer Vielzahl verschiedener Enol-Silane und α,β-ungesättigte Carbonylverbindungen durchführen. Als Katalysator wird eine Lewis-Säure verwendet.[1][2]
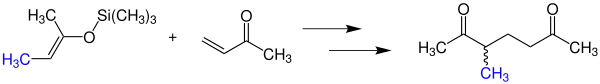
Neben der gezeigten Variante mit Methylgruppen können beliebige andere Alky- und Arylreste verwendet werden. Untersuchungen haben gezeigt, dass anstatt von silylierten Enolen ebenfalls Silyl-Acetale verwendet werden können.[2]
Mechanismus
Mechanistisch gesehen handelt es sich bei der Mukaiyama-Michael-Reaktion um das Gegenstück zur basenkatalysierten Michael-Addition. Ein möglicher Mechanismus könnte wie folgt aussehen:[2]

Bei diesem Mechanismus spielt die Komplexbildung um die eingesetzte Lewis-Säure, in diesem Fall TiCl4 eine wichtige Rolle. Im eigentlichen Reaktionsschritt greift die Doppelbildung der Carbonylverbindung 1 an dem Silizium-Atom der Trimethylsilylgruppe an. Daraufhin bildet sich die Ketoform des verwendeten Enol-Silans. Diese Ketoform bildet eine neue Kohlenstoff-Kohlenstoff-Bindung aus. Der beschriebene Prozess läuft konzertiert ab. Nach der Abspaltung des Katalysators entsteht ein Gemisch aus dem syn- und dem anti-Diastereomer des Zwischenprodukts 2. Nach Aufarbeitung, sprich Hydrolyse, erhält man das Produkt 3, ebenfalls als Gemisch aus syn- und anti-Diastereomer.
Anwendung
Aufgrund der guten Regio- und Stereoselektivität der Mukaiyama-Michael-Reaktion findet diese zahlreiche Anwendung in der modernen Synthesechemie.[2] Sie wird beispielsweise zur Synthese von γ-Butenoliden benutzt.[3]
Einzelnachweise
- Koichi Narasaka, Kenso Soai, Teruaki Mukaiyama: The new michael reaction. In: Chemistry Letters. Band 3, Nr. 10, 5. Oktober 1974, S. 1223–1224, doi:10.1246/cl.1974.1223.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. 3 Bände. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1996–1999, doi:10.1002/anie.201000292.
- Sean P. Brown, Nicole C. Goodwin, David W. C. MacMillan: The First Enantioselective Organocatalytic Mukaiyama−Michael Reaction. A Direct Method for the Synthesis of Enantioenriched γ-Butenolide Architecture. In: Journal of the American Chemical Society. Band 125, Nr. 5, 1. Februar 2003, S. 1192–1194, doi:10.1021/ja029095q, PMID 12553821.