Lobata
Die Lobata sind eine biologisch bedeutsame Ordnung von Rippenquallen (Ctenophora) aus der Klasse Tentaculata. Sie zeichnen sich durch ihre muskulösen Mundlappen aus, die an Stelle der bei anderen Rippenquallen bevorzugt benutzten Tentakel zum Beutefang eingesetzt werden.
| Lobata | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
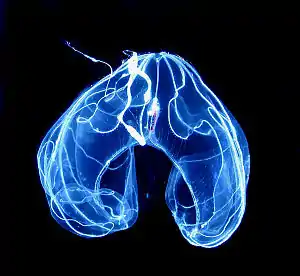
Bathocyroe fosteri | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Lobata | ||||||||||||
| Eschscholtz, 1825 |
Aufbau
Die Körperform der bis zu 25 Zentimeter großen Lobata wird durch drei senkrecht aufeinander stehende Achsen beschrieben, die Körperlängsachse zwischen Mund und Gleichgewichtsorgan, die tentakuläre Achse als Verbindungsachse der beiden Tentakelscheiden und die pharyngeale Achse senkrecht dazu. Die tentakuläre Achse ist kürzer als die pharyngeale Achse, so dass sich ein ovaler Querschnitt ergibt.
Zwei große muskeldurchzogene Mundlappen flankieren den stielförmig vorstehenden Mund und die beiden auf der Mundseite gelegenen Tentakel, die je nach Art unterschiedlich deutlich ausgeprägt und in der Gattung Ocyropsis sogar ganz abwesend sind. Auf diese Weise entsteht zwischen der Mundseite und den beiden Mundlappen eine schirmartige Höhlung wie sie auch bei den nicht verwandten Quallen der Nesseltiere zu finden ist.
An den beiden Tentakelscheiden entspringen je zwei langgezogene Vertiefungen in der Körperwand, die aurikularen Furchen, die über die Schirmunterseite nach außen je zu einem Mundlappen hinlaufen und mit langen Fäden, den Tentillen, besetzt sind. Diese tragen zahlreiche Klebekörperchen (Colloblasten), die zum Beutefang dienen.
Die wie bei allen Rippenquallen von der Statocyste, dem Gleichgewichtsorgan, am mundabgewandten Ende ausgehenden Kammrippen lassen sich in zwei Gruppen einteilen: Je zwei von ihnen laufen parallel in die beiden Mundlappen links und rechts des Mundes hinein; die vier anderen verlaufen senkrecht dazu annähernd in der Tentakelebene und setzen sich mundseitig in vier kegelförmigen Körperanhängen, den Aurikeln, fort, die aber statt Kammplättchen lange Geißeln tragen. Eine Besonderheit der Lobata ist es, dass sich auf allen Kammrippen zwischen den einzelnen Plättchen eine mit Geißeln besetzte Furche befindet, die vermutlich auf mechanische Weise das Schlagsignal der Statocyste weiterleitet. Auch Beschädigungen der Kammrippen können so relativ schnell behoben werden. Letzteres könnte für die auf aktive Fortbewegung angewiesenen Lobata der entscheidende Grund für die Ausbildung dieser Innovation gewesen sein.
Das vom zentral gelegenen Magen ausgehende Kanalsystem besteht aus zwei paragastrischen Kanälen, die an den beiden Schlundseiten entlang zum Mundende laufen sowie vier zum mundabgewandten Ende nach außen laufenden Transversalkanälen. Diese teilen sich Y-förmig auf und setzen sich in den Meridionalkanälen fort, die unterhalb der Kammrippen zum Mundende laufen und dabei in zwei Schleifensystemen auch die Mundlappen durchqueren. Sie vereinigen sich in einem zirkumoralen, also um den Mund herum gelegenen Ringkanal mit den Enden der paragastrischen Kanäle.
Verbreitung und Lebensraum
Lobata-Arten bilden einen wichtigen Bestandteil des Meeresplanktons und kommen weltweit in allen Meeresgewässern vor. Sie leben allesamt pelagisch, also im freien Wasser.
Fortbewegung und Ernährung
Lobata schwimmen mit der Mundseite voran; obwohl sie dazu unterstützend ihre Kammrippen einsetzen, kommt der Vortrieb hauptsächlich durch Wellenbewegungen ihrer muskulösen Mundlappen und Aurikeln zustande.
Die auf den vier Aurikeln sitzenden Geißeln erzeugen eine Wasserströmung, durch die Beute wie Fischlarven, kleine Krebse und anderes Zooplankton um diese herum über die ausgestreckten Tentillen der aurikularen Tentillenbänder geleitet wird, wo sie an den durch Berührung aktivierten Colloblasten hängenbleibt und dann zum Mund transportiert wird.
Die Aurikeln erzeugen nicht nur den zum Mund hingeleiteten Nahrungsstrom, sondern sind anscheinend auch zur Wahrnehmung in der Nähe befindlicher Beute befähigt und können die Strömungsrichtung des Wassers entsprechend aktiv steuern – Lobata-Rippenquallen zeigen damit ein größeres Verhaltensrepertoire, als man bis zum Ende des zwanzigsten Jahrhunderts für möglich gehalten hätte.
Das zum Beutefang eingesetzte System der Mundlappen und Aurikeln kann als Alternative zu den Tentakeln angesehen werden: Im Gegensatz zu diesen ermöglicht es die ununterbrochene Nahrungsaufnahme von passiv im Wasser schwebender oder nur langsam schwimmender Beute aus dem Mikro- und Mesozooplankton. Anders als die zweite größere Gruppe von Rippenquallen, die Cydippida, die in einem als „Spin Capture“ bezeichneten Vorgang immer erst ihre Tentakel einziehen und durch eine Drehung ihres Körpers zum Mundende bringen müssen, sind sie daher eher auf kleinere Beute spezialisiert. Als Folge treten sie mit den Cydippida kaum in Nahrungskonkurrenz, sondern können durch ihre alternative Strategie mit diesen koexistieren. Von manchen Wissenschaftlern wird dies als selektiver Vorteil angesehen, der die stammesgeschichtliche Entstehung der Lobata aus Cydippida-ähnlichen Vorfahren begünstigt hat.
Fortpflanzung

Lobata pflanzen sich ausschließlich auf sexuelle Weise fort. Die meisten sind Zwitter, besitzen also sowohl männliche als auch weibliche Keimdrüsen; Selbstbefruchtung spielt dennoch wahrscheinlich nur bei den Arten der Gattung Mnemiopsis eine große Rolle. Oft werden erst die männlichen und dann die weiblichen Keimzellen ins Wasser abgegeben, wo die Befruchtung stattfindet. Die weitere Entwicklung läuft über ein Cydippea-Stadium, das wie eine Miniaturversion einer Cydippida-Rippenqualle aussieht, aber noch keine Mundlappen hat. Da sich die Jungtiere weder im Lebensraum noch im Aussehen wesentlich von den Erwachsenen unterscheiden, spricht man meist nicht von einer Larve, die Entwicklung ist also direkt.
Bei den Arten der Gattung Ocyropsis treten die Geschlechtsorgane im Gegensatz zu allen anderen Rippenquallen immer getrennt auf, es lassen sich also männliche und weibliche Individuen unterscheiden.
Ein bemerkenswertes Phänomen, dass bei einigen Lobata-Arten auftritt, ist die so genannte Dissogenie: Einige Jungtiere werden vorzeitig geschlechtsreif und beginnen mit der Produktion von Keimzellen; im Laufe der weiteren Entwicklung bilden sich ihre Keimdrüsen jedoch zurück, um erst in der Erwachsenenphase wiederzukehren.
Einfluss von Lobata in fremden Ökosystemen
Im Jahr 1982 wurde die Lobata-Art Mnemiopsis leidyi erstmals im vorher nicht von Rippenquallen besiedelten Schwarzen Meer beobachtet, wohin sie vermutlich mit dem Ballastwasser von Schiffen gelangt war, die zuvor die Gewässer des nordwestlichen Atlantik durchquert hatten. Ohne natürliche Feinde explodierte die Population wenige Jahre später und vertilgte nicht nur zahlreiche Fischeier und -larven, sondern verdrängte auch erfolgreich innerhalb von nur zehn Jahren alle Nahrungskonkurrenten um die Planktonbestände, so dass insbesondere die Sardellen-Fischerei vollkommen zusammenbrach. Die Vorteile von Mnemiopsis leidyi bestanden anscheinend nicht nur darin, ihre Konkurrenten schon im Ei- oder Larvenstadium vertilgen zu können, sondern auch in der früher begonnenen Nahrungsaufnahme, so dass das vorhandene Zooplankton mengen- und artenmäßig bereits erheblich reduziert war, wenn die verbliebenen Fischlarven schließlich zu erwachsenen Tieren herangereift waren.
Erst mit dem zusätzlichen Auftreten einer weiteren, auf Mnemiopsis leidyi als Beutetier spezialisierten Rippenqualle, Beroe ovata, im Jahre 1997 gelangte das Ökosystem wieder ins Gleichgewicht; dennoch ist seitdem das Schwarze Meer mit zwei ortsfremden Arten besiedelt. Ein ähnliches Phänomen ist zu Beginn des 21. Jahrhunderts im Kaspischen Meer zu beobachten, wohin Mnemiopsis leidyi 1998 oder 1999 vermutlich im Ballastwasser von Schiffen gelangte, die den Wolga-Don-Kanal befahren.
Inzwischen ist sie auch in die westl. Ostsee verschleppt worden, wie Funde im Oktober 2006 in der Kieler Förde belegen.
Stammesgeschichte
Fossilien, die den Lobata zugeordnet werden können, sind bis heute nicht bekannt, so dass die stammesgeschichtlichen Verwandtschaftsverhältnisse allein aus dem Vergleich mit anderen modernen Rippenquallen erschlossen werden müssen. Eine vorläufige molekulargenetische Studie ergab, dass eine Gruppe aus den Lobata zusammen mit den Cestida und den Thalassocalycida ein monophyletisches Taxon bildet, also alle Nachkommen des letzten gemeinsamen Vorfahren dieser Tiere umfasst. Morphologische Eigenheiten der Ganeshida, einer Ordnung, die in die vorbenannte Studie nicht einbezogen wurde, deuten darauf hin, dass auch dieses Taxon möglicherweise in denselben Verwandtschaftskreis gehört.
Systematik

.jpg.webp)
Ob die Lobata selbst ein monophyletisches Taxon darstellen, ist noch nicht geklärt; möglicherweise sind einige Lobata-Arten enger mit Rippenquallen aus der Ordnung Thalassocalycida verwandt als mit anderen Lobata-Arten. In diesem Falle wäre das Taxon Lobata paraphyletisch, umfasste also nicht alle Nachkommen der Stammart.
Die folgende Aufstellung (Stand: 25. April 2017) nennt die derzeit validen Familien, Gattungen und Arten der Lobata nach der Aufstellung von Claudia E. Mills (University of Washington, USA).[1]
Ordnung Lobata Eschscholtz, 1825
- Familie Bathocyroidae Harbison und Madin, 1982
- Gattung Bathocyroe Madin und Harbison, 1978
- Bathocyroe fosteri Madin und Harbison, 1978
- Bathocyroe longigula Horita, Akiyama und Kubota, 2011
- Bathocyroe paragaster (Ralph und Kaberry, 1950)
- Gattung Bathocyroe Madin und Harbison, 1978
- Familie Bolinopsidae Bigelow, 1912
- Gattung Bolinopsis L.Agassiz, 1860
- Bolinopsis ashleyi Gershwin, Zeidler und Davie, 2010
- Bolinopsis chuni (von Lendenfeld, 1884)
- Bolinopsis elegans (Mertens, 1833)
- Bolinopsis indosinensis Dawydoff, 1946
- Bolinopsis infundibulum (O.F.Müller, 1776)
- Bolinopsis mikado (Moser, 1907)
- Bolinopsis ovalis (Bigelow, 1904)
- Bolinopsis rubripunctata Tokioka 1964
- Bolinopsis vitrea (L.Agassiz, 1860)
- Gattung Lesueuria Milne Edwards, 1841
- Lesueuria hyboptera A.Agassiz, 1865
- Lesueuria pinnata Ralph und Kaberry, 1950
- Lesueuria tiedemanni (Eschscholtz, 1829)
- Lesueuria vitrea Milne Edwards, 1841
- Gattung Mnemiopsis L.Agassiz, 1860
- Mnemiopsis gardeni L.Agassiz, 1860
- Mnemiopsis leidyi A.Agassiz, 1865
- Gattung Bolinopsis L.Agassiz, 1860
- Familie Leucotheidae Krumbach, 1925
- Gattung Leucothea Mertens, 1833
- Leucothea filmersankeyi Gershwin, Zeidler und Davie, 2010
- Leucothea japonica Komai, 1918
- Leucothea multicornis (Quoy und Gaimard, 1824)
- Leucothea ochracea Mayer, 1912
- Leucothea pulchra Matsumoto, 1988
- Gattung Leucothea Mertens, 1833
- Familie Ocyropsidae Harbison & Madin, 1982
- Gattung Alcinoe Rang, 1828
- Alcinoe rosea Mertens, 1833
- Alcinoe vermicularis Rang, 1828
- Gattung Ocyropsis Mayer, 1912
- Ocyropsis crystallina (Rang, 1827)
- Ocyropsis fusca (Rang, 1827)
- Ocyropsis maculata (Rang, 1827)
- Ocyropsis pteroessa Bigelow 1904
- Ocyropsis vance Gershwin, Zeidler und Davie, 2010
- Gattung Alcinoe Rang, 1828
- Familie Eurhamphaeidae L.Agassiz, 1860
- Gattung Eurhamphaea Gegenbaur, 1856
- Eurhamphaea chamissonis (Eschscholtz, 1829)
- Eurhamphaea heteroptera (Chamisso und Eysenhardt, 1821)
- Eurhamphaea kuhlii (Eschscholtz, 1829)
- Eurhamphaea schweiggeri (Eschscholtz, 1829)
- Gattung Deiopea Chun, 1879
- Deiopea kaloktenota Chun, 1879
- Gattung Kiyohimea Komai und Tokioka, 1940
- Kiyohimea aurita Komai und Tokioka, 1940
- Kiyohimea usagi Matsumoto und Robison, 1992
- Gattung Eurhamphaea Gegenbaur, 1856
- Familie Lampoctenidae Harbison, Matsumoto und Robison, 2001
- Gattung Lampocteis Harbison, Matsumoto und Robison, 2001
- Lampocteis cruentiventer Harbison, Matsumoto und Robison, 2001
- Gattung Lampocteis Harbison, Matsumoto und Robison, 2001
- Familie Lobatolampeidae Horita, 2000
- Gattung Lobatolampea Horita, 2000
- Lobatolampea tetragona Horita, 2000
- Gattung Lobatolampea Horita, 2000
Arten der Lobata incertae sedis
- Axiotima gaedii Eschscholtz, 1829
- Calya trevirani Eschscholtz, 1829
Literatur
- G. R. Harbison, R. L. Miller: Not all ctenophores are hermaphrodites, Studies on the systematics, distribution, sexuality and development of two species of Ocyropsis. in: Journal of Marine Biology. 90.1986, S. 413.
- G. I. Matsumoto, G. R. Harbison: In situ observations of foraging, feeding, and escape behaviour in three orders of oceanic ctenophores, Lobata, Cestida, and Beroida. in: Journal of Marine Biology. 117.1993, S. 279.
- T. A. Shiganova: Invasion of the Black Sea by the ctenophore Mnemiopsis leidyi and recent changes in pelagic community structure. in: Fisheries Oceanography. Blackwell Science, Oxford 1997–1998, S. 305. ISSN 1365-2419
Einzelnachweise
- Phylum Ctenophora: list of all valid species names, by Claudia E. Mills abgerufen am 25. April 2017