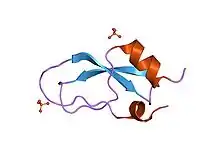
Kunitz-Domäne
Kunitz-Domänen sind Proteasen hemmende Proteindomänen von Protease-Inhibitoren des Kunitz-Typs, wie beispielsweise dem Bovine Pancreatic Trypsin Inhibitor (BPTI, Aprotinin), dem Tissue Factor Pathway Inhibitor (TFPI), dem Alzheimer Amyloid β-Protein Precursor (APPI) und dem Inter-α-Trypsin Inhibitor. Kunitz-Domänen, die eine Länge von etwa 60 Aminosäuren haben, stellen selbst stabile Proteine dar und können Proteasen, wie beispielsweise Trypsin, Chymotrypsin und Kallikrein, hemmen. Daher sind Kunitz-Domänen ein beliebtes Grundgerüst für die Entwicklung neuer Arzneistoffe. Mit Ecallantid wurde 2009 in den USA das erste Kunitz-Domänenpeptid als Arzneimittel zugelassen.[1]
Arzneistoffentwicklung
Das Interesse der pharmazeutischen Industrie an Kunitz-Domänen zur Entwicklung von Biopharmazeutika basiert auf deren Fähigkeit, Proteinstrukturen selektiv zu erkennen. Diese mit anderen Antikörpermimetika gemeinsame Eigenschaft wird von deren Fähigkeit der Bindung im aktiven Zentrum eines Enzyms, verbunden mit einer kompetitiven, reversiblen Hemmung, ergänzt. Mit Hilfe von Displaytechniken, wie dem Phagendisplay, werden aus Molekülbibliotheken, die über 10 Millionen verschiedene Varianten von Kunitz-Domänen enthalten, geeignete Domänen selektiert. Nach einer Charakterisierung und Optimierung selektierter Domänen kann eine großtechnische Herstellung mit Hilfe in der Biotechnologie gebräuchlicher Produktionsorganismen erfolgen. Auf diese Weise konnten beispielsweise der Kallikrein-Inhibitor Ecallantid und der Neutrophile-Elastase-Hemmer Depelestat gefunden werden.
Einzelnachweise
- Dyax Corp.: Full prescibing information Kalbitor (PDF; 169 kB) 2009. Abgerufen am 2. Mai 2010.
Literatur
- Nixon AE, Wood CR: Engineered protein inhibitors of proteases. In: Curr Opin Drug Discov Devel. 9, Nr. 2, März 2006, S. 261–8. PMID 16566296.