Kondakov-Acylierung
Die Kondakov-Acylierung, auch Kondakoff-Acylierung, ist eine Namensreaktion in der organischen Chemie und wurde erstmals im Jahre 1892 von I. L. Kondakow veröffentlicht. A. G. Darzens veröffentlichte 1910 Erweiterungen der Reaktion, wodurch die Reaktion auch als Darzens-Olefin-Acylierung bekannt ist.[1] Die Reaktion beschreibt die Synthese von β-Halogenketonen aus Alkenen und Carbonsäurehalogeniden.[2]
Übersichtsreaktion
Ein Alken, z. B. 2,3-Dimethyl-2-buten, reagiert mit einem Carbonsäurehalogenid (X meist Cl), unter Einfluss einer Lewis-Säure, zu einem β-Halogenketon:

Reaktionsmechanismus
Der Reaktionsmechanismus ist in der Literatur[3] beschrieben. Der Mechanismus wird hier mit einem Carbonsäurechlorid und Aluminiumchlorid als Lewis-Säure illustriert.
Unter Zugabe von Aluminiumchlorid als Lewis-Säure reagiert das Carbonsäurechlorid 1 zu einem Acyl-Ion. Das Aluminiumchlorid wird hierbei zu Tetrachloroaluminat umgesetzt:
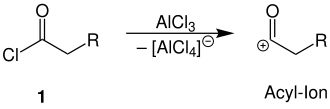
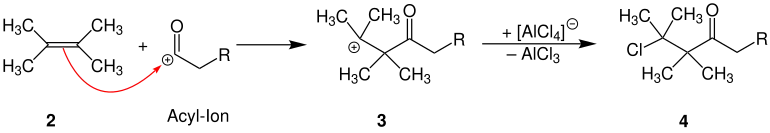
Das reaktive Acyl-Ion reagiert mit einem Alken – im Beispiel 2,3-Dimethyl-2-buten (2) – zur Zwischenstufe 3. Unter Rückbildung des Tetrachloroaluminat zu Aluminiumchlorid reagiert Zwischenstufe 3 zum β-Chlorketon 4:
Einzelnachweise
- Herbert H. Seltzman, Yung Ao Hsieh, Colin G. Pitt und Patricia H. Reggio (1991): Synthesis of rotationally restricted tetrahydrocannabinol ethers In: J. Org. Chem. 56 (4), S. 1549–1553, doi:10.1021/jo00004a039.
- Kondakoff, J. (1893): Ueber die Synthesen unter dem Einfluss von Zinkchlorid, Journal für praktische Chemie, 48, S. 467–486. doi:10.1002/prac.18930480148.
- Z. Wang: Comprehensive organic name reactions and reagents Volume 1. John Wiley, Hoboken (N.J.) 2009, ISBN 978-0-470-28662-3, S. 848–850.