Herddosis
Herddosis (HD) ist diejenige Dosis an ionisierender Strahlung (Strahlendosis), die im Rahmen einer Therapie (Strahlentherapie oder nuklearmedizinische Therapie) das Zielgewebe (Herd) erreicht. Da die Herddosis in der Regel im Zielgewebe nicht gemessen werden kann, werden vor der Therapie Berechnungen zur Dosisermittlung angestellt.
Die Herddosis wird als Herd-bezogene Energiedosis in Gray (Gy) angegeben. Typische angestrebte Herddosen liegen bei der Strahlentherapie gutartiger Erkrankungen in der Größenordnung von 0,5 bis 20 Gy; bei bösartigen Erkrankungen im Bereich von 45 bis 80 Gy. Bei der Radiojodtherapie gutartiger Schilddrüsenerkrankungen werden Herddosen von 120 bis 400 Gy angestrebt; bei der Behandlung des Schilddrüsenkrebses werden auch über 1000 Gy erreicht.
Nicht zu verwechseln ist die Herddosis mit der Äquivalentdosis (gemessen in Sievert), die sich – nach Strahlenart und jeweiligem Organ gewichtet – meist auf den gesamten Körper eines Individuums bezieht. Hier können bereits Ganzkörper-Dosen von wenigen Sievert zum Tode führen.
Bestrahlungsplanung in der Strahlentherapie
siehe Hauptartikel Strahlentherapie
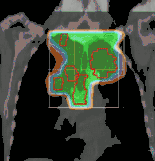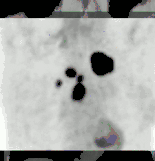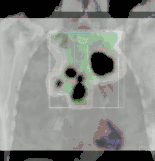
Für die Strahlentherapie wird festgelegt, welche Strahlenart in welcher Intensität aus welcher Richtung auf das Zielgewebe einwirken soll (Bestrahlungsplanung). Vom Strahlentherapeuten wird eine bestimmte Herddosis in Gray verordnet. Da die Dosis im Körper erheblich schwankt, muss zusätzlich der Punkt oder das Volumen angegeben werden, für den diese Dosis gelten soll. Das ist eine nicht triviale Aufgabe. In der Praxis verwendet man häufig das Isozentrum der Feldanordnung. Auch die tumorumschließende Isodose kann als Referenzangabe dienen. Diese Angaben können aber ungenau sein, weil die Beurteilung, welches Gewebe in den CT-Bildern dem Tumor zuzurechnen ist und welches nicht, oft schwierig ist. In wissenschaftlichen Studien, die höchste Exaktheit fordern, werden die Definitionen der ICRU (ICRU-Report Nr. 50, 1993) herangezogen. Beispielsweise ist dort festgelegt, dass der Dosis-Referenzpunkt innerhalb des sichtbaren Tumors (GTV, gross tumor volume) liegen soll, oder dass die Dosis innerhalb des gesamten Planungsvolumens nirgendwo unter 95 % oder über 107 % der angegebenen Referenzdosis liegen darf. Moderne Strahlentherapiepläne integrieren außer den CT- und MR-Bildern zunehmend funktionelle Daten aus der Positronenemissionstomographie, um das, was als „Herd“ zu gelten hat und mit der Herddosis behandelt werden muss, genauer abgrenzen zu können.[1]
Bei der Anwendung von untypischen Fraktionierungsschemata kann anstelle der echten physikalischen Herddosis auch die biologische Äquivalenzdosis (BED) angegeben werden,[2] also die gleichwirksame Dosis in konventioneller Fraktionierung (2 Gy täglich 5×/Woche), berechnet nach dem linearquadratischen Modell. Diese strahlentherapeutische Größe darf nicht mit der Äquivalentdosis aus dem Strahlenschutz verwechselt werden.
Dosisermittlung in der Nuklearmedizin
Im Bereich der nuklearmedizinischen Therapie wird die Dosis im Vorhinein unter Berücksichtigung des MIRD-Schema (Medical Internal Radiation Dose) bestimmt. Dazu werden insbesondere die Verteilung des Radiopharmakons im Körper (Uptake im Zielorgan) und die effektive Halbwertszeit beachtet. Für alle routinemäßig angewandten Therapieformen liegen diesbezüglich Abschätzungen vor. Für die Radiojodtherapie erfolgt die standardisierte Dosisermittlung im Rahmen eines Radiojodtests.
Da die tatsächliche effektive Halbwertszeit und der tatsächlich erreichte Uptake im Zielorgan während der Therapie von den vorher bestimmten Parametern abweichen können, kann in der nuklearmedizinischen Therapie – im Gegensatz zur Strahlentherapie – auch die letztlich erzielte Herddosis von der angestrebten Herddosis zum Teil erheblich abweichen.
Siehe auch
Literatur
- A. Schaefer, D. Hellwig: Dosimetrie. In: T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause: Nuklearmedizin. Stuttgart / New York 2008, ISBN 978-3-13-118504-4.
Einzelnachweise
- S. Mutic: PET and PET/CT for Radiotherapy Planning. In: W. Schlegel, T. Bortfeld, A. Grosu (Hrsg.): New Technologies in Radiation Oncology. Springer, Berlin / Heidelberg 2006, ISBN 3-540-00321-5, S. 133–149.
- B. Jones u. a.: Biological equivalent dose assessment of the consequences of hypofractionated radiotherapy. In: Int J Radiat Oncol Biol Phys., 47, 2000, S. 1379–1384; PMID 10889393