Grignard-Abbau
Der Grignard-Abbau ist eine Namensreaktion der Organischen Chemie und wurde 1934 von dem deutschen Chemiker Wilhelm Steinkopf (1879–1949) entdeckt. Der Name der Abbaureaktion ist auf Victor Grignard (1871–1935) zurückzuführen, denn diese ist mit der Grignard-Reaktion verwandt. Beim Grignard-Abbau handelt es sich um eine Dehalogenierung von Polyhalogenverbindungen, wobei eine Verbindung mit einem Halogenatom weniger entsteht.[1]
Übersichtsreaktion
Die Polyhalogenverbindung wie beispielsweise 2,3,4,5-Tetrabromthiophen bildet mit Magnesium in Diethylether eine Grignard-Verbindung, die durch das Versetzen mit Wasser zu einer Polyhalogenverbindung mit einem Halogenatom weniger reagiert. In diesem Fall entsteht 2,3,4-Tribromthiophen und Magnesiumbromhydroxid wird abgespalten:[2][3]
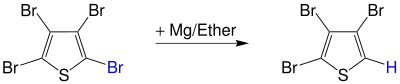
Neben bromierte Edukten werden chlorierte oder fluorierte aromatische Verbindungen eingesetzt.[4]
Mechanismus
Ein Reaktionsmechanismus ist noch nicht vollständig geklärt worden, kann aber am Beispiel von 2,3,4,5-Tetrabromthiophen 1 gezeigt werden.
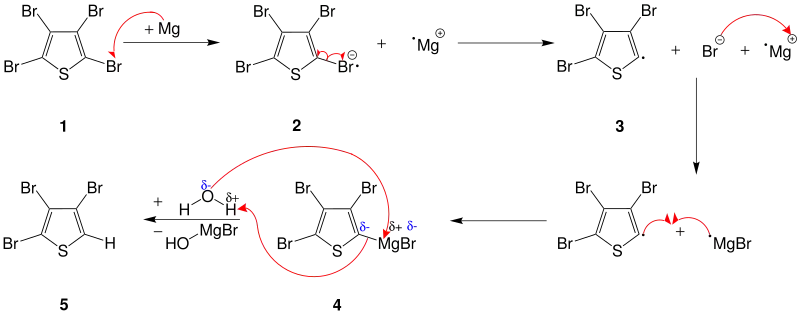
Im ersten Schritt findet an der Magnesiumoberfläche ein Elektronenaustausch statt,[5] indem das Magnesiumatom ein Elektron auf das Brom überträgt und somit ein Radikalanion 2 entsteht. Aufgrund der schwachen Bindung zwischen dem Kohlenstoff und Brom zerfällt das Radikalanion zu einem Thiophenyl-Radikal 3 und einem Bromid-Ion. Das Letztere reagiert mit dem Magnesiumradikal zu einem Magnesiumbromidradikal. Nun können sich die beiden Radikale zu einem Grignard-Reagenz 4 verbinden. Als nächsten Schritt wird Wasser dazugegeben. Das Sauerstoffatom des Wassers greift mit seinen freien Elektronen das positiv polarisierte Magnesiumatom in der Grignard-Verbindung an. Gleichzeitig wird ein Wasserstoffatom des Wassers von dem negativ polarisierten Kohlenstoffatom angezogen und es findet eine intramolekulare Protonenwanderung statt. Nach der Abspaltung des Magnesiumbromhydroxids entsteht das gewünschte Produkt 2,3,4-Tribromthiophen 5.[6]
Siehe auch
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, 2009, ISBN 978-0-471-70450-8, S. 1271–1272.
- W. Steinkopf, H. Jacob, H. Penz: Studien in der Thiophenreihe. XXVI. Isomere Bromthiophene und die Konstitution der Thiophendisulfonsäuren. In: Liebigs Annalen. Band 512, 1934, S. 136–146, doi:10.1002/jlac.19345120113.
- M. Windholz, S. Budavari, L. Y. Stroumtsos, M. N. Fertig: The Merck Index - An Encyclopedia of Chemicals und Drugs. Merck & Co., 1976, ISBN 0-911910-26-3, S. ONR-38.
- W. Steinkopf, H. Jacob, H. Penz: Studien in der Thiophenreihe. XXVI. Isomere Bromthiophene und die Konstitution der Thiophendisulfonsäuren. In: Liebigs Annalen. Band 512, 1934, S. 136–146, doi:10.1002/jlac.19345120113.
- Reinhard Brückner: Reaktionsmechanismen. 3. korrigierte Auflage. Spektrum Akademischer Verlag, 2007, ISBN 978-3-8274-1579-0, S. 774.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, 2009, ISBN 978-0-471-70450-8, S. 1271–1272.