Gesetz der konstanten Proportionen
Das Gesetz der konstanten Proportionen besagt, dass die Elemente in einer bestimmten chemischen Verbindung immer im gleichen Massenverhältnis vorkommen. Das Massenverhältnis im Natriumchlorid zum Beispiel ist immer 39 % Natrium zu 61 % Chlor.
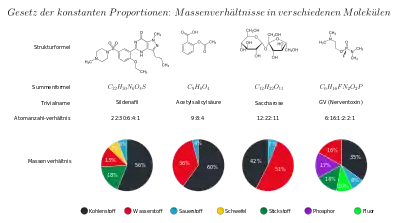
Diese von Joseph-Louis Proust 1797 formulierte und nach ihm auch Proustsches Gesetz genannte Regel ist der Ausgangspunkt der Entwicklung der Stöchiometrie. John Dalton erweiterte es zum Gesetz der multiplen Proportionen.
Das Gesetz selbst war im 18. Jahrhundert schon Gemeingut der praktisch tätigen Chemiker geworden und wurde zum Beispiel in der französischen Enzyklopädie 1765 als Dogma von ewiger Wahrheit bezeichnet.[1] Joseph Louis Proust unternahm von 1797 bis 1809 zahlreiche Experimente und Analysen von Mineralien und Oxiden, in denen er das Gesetz bestätigt fand, und er formulierte es in mehreren Veröffentlichungen, darunter eine von 1797 und eine von 1799.[2] Größere Aufmerksamkeit fand das ansonsten stillschweigend vorausgesetzte Gesetz bei den Chemikern erst, als Claude Louis Berthollet das Gesetz in seinem 1803 veröffentlichten Essai de statique chimique kritisierte. Berthollet vertrat die Auffassung, dass in gewissen Grenzen beliebige Verhältnisse auftreten. Proust wies in dem Disput nach, dass es sich bei den von Berthollet untersuchten Oxiden um Mischungen verschiedener Oxide desselben Metalls handelte, aber jeweils in konstantem Verhältnis von Metall zu Sauerstoff.[3] Er nahm also das im Allgemeinen Dalton zugeschriebene Gesetz der multiplen Proportionen schon vorweg. Es gibt noch ein weiteres, schärferes stöchiometrisches Gesetz, das besagt, dass sich die Elemente im Verhältnis ihrer Äquivalentgewichte zu Verbindungen zusammenfinden, und das von Jeremias Benjamin Richter (1792) stammt.[4] Das Gesetz der konstanten Proportionen wurde im 19. Jahrhundert noch zweimal intensiv überprüft, von Jöns Jakob Berzelius (ab 1810) und Jean Servais Stas (1860, 1865), der sehr genaue Atomgewichtsbestimmungen durchführte.
Diese von Proust und anderen gemachten Beobachtungen waren ein wesentlicher Schritt zur Entwicklung der Atomhypothese durch Dalton. Denn das immer gleiche Massenverhältnis der Elemente im Natriumchlorid lässt sich mit ihr am einfachsten erklären: Natriumchlorid ist aus gleich vielen Natrium- und Chlorteilchen aufgebaut. Dabei ist ein Chlorteilchen um die Hälfte schwerer als ein Natriumteilchen. Andere Beispiele wären Kupfer(I)-sulfid (Massenverhältnis m(Cu) : m(S) etwa 4 : 1, Stoffmengenverhältnis n(Cu) : n(S) = 2 : 1; ein Kupferteilchen ist zwei Mal so massereich wie ein Schwefelteilchen) oder Schwefelsäure (mit n(H) : n(S) : n(O) = 2 : 1 : 4, vgl. Abbildung und – zum Unterschied von Masse und Menge – unter Liste von Größenordnungen der Stoffmenge).
Siehe auch
Literatur
- Eintrag zu Proustsches Gesetz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
Einzelnachweise
- Jost Weyer, Geschichte der Chemie, Band 2, Springer 2018, S. 10
- J. R. Partington, A history of chemsitry, Macmillan 1962, Band 3, S. 647f
- Weyer, Geschichte der Chemie, Band 2, 2018, S. 11
- Jost Weyer, Geschichte der Chemie, Band 2, S. 12f