Fritsch-Buttenberg-Wiechell-Umlagerung
Die Fritsch-Buttenberg-Wiechell-Umlagerung ist eine Namensreaktion der organischen Chemie, die nach ihren Entdeckern Paul Ernst Moritz Fritsch (1859–1913), Wilhelm Paul Buttenberg und Heinrich G. Wiechell benannt ist. Es handelt sich um eine Umlagerungsreaktion, bei der ein 1,1-disubstituiertes Vinylhalogenid zu einem Alkin umgesetzt wird. Die Substituenten können dabei Aryl- oder Alkylsubstituenten[1], aber auch Wasserstoffatome sein. Sie wird mit einer starken Base (z. B. einem Alkoholat oder Butyllithium) durchgeführt.[2][3][4][5]
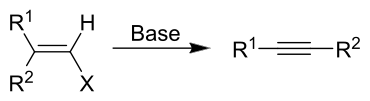
Reaktionsmechanismus
Der vorgeschlagene Reaktionsmechanismus der Fritsch-Buttenberg-Wiechell-Umlagerung sei hier beispielhaft mit einem Alkoholat dargestellt.[6]
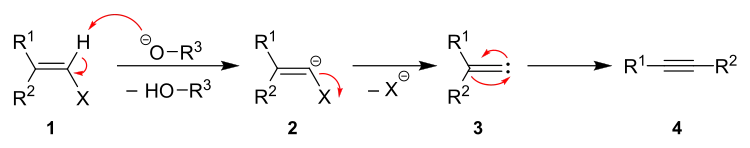
Die Reaktion beginnt mit dem Vinylhalogenid 1. Eine starke Base, hier ein Alkoholat, deprotoniert das Alken, wobei der entsprechende Alkohol und das Alkenylanion 2 gebildet werden. Es folgt eine Eliminierung des Halogenids, wobei intermediär das Carben 3 entsteht. Nach Wanderung eines der beiden Substituenten wird unter Ausbildung einer Dreifachbindung das Alkin 4 gebildet.
Praktische Anwendung
Die Fritsch-Buttenberg-Wiechell-Umlagerung kann unter anderem für die Synthese terminaler Alkine genutzt werden. So können beispielsweise alkinylierte Steroidhormone dargestellt werden, die von pharmazeutischem Interesse sind.[7]

Literatur
- Benjamin Darses, Anne Milet, Christian Philouze, Andrew E. Greene, Jean-François Poisson: Ynol Ethers from Dichloroenol Ethers: Mechanistic Elucidation Through 35Cl Labeling. In: Organic Letters. Band 10, Nr. 20, 16. Oktober 2008, S. 4445–4447, doi:10.1021/ol801704u.
Einzelnachweise
- H. Rezaei, S. Yamanoi, F. Chemla, J. F. Normant: Fritsch−Buttenberg−Wiechell Rearrangement in the Aliphatic Series. In: Organic Letters. Band 2, Nr. 4, 1. Februar 2000, S. 419–421, doi:10.1021/ol991117z.
- Paul Fritsch: Ueber die Darstellung von Diphenylacetaldehyd und eine neue Synthese von Tolanderivaten. In: Justus Liebigs Annalen der Chemie. Band 279, Nr. 3, 1. Januar 1894, S. 319–323, doi:10.1002/jlac.18942790310.
- W. P. Buttenberg: Condensation des Dichloracetals mit Phenol und Toluol. In: Justus Liebigs Annalen der Chemie. Band 279, Nr. 3, 1. Januar 1894, S. 324–337, doi:10.1002/jlac.18942790311.
- H. Wiechell: Condensation des Dichloracetals mit Anisol und Phenetol. In: Justus Liebigs Annalen der Chemie. Band 279, Nr. 3, 1. Januar 1894, S. 337–344, doi:10.1002/jlac.18942790312.
- G. Köbrich: Eliminations from Olefins. In: Angewandte Chemie International Edition in English. Band 4, Nr. 1, 1. Januar 1965, S. 49–68, doi:10.1002/anie.196500491.
- Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro, Jr.: Name Reactions and Reagents in Organic Synthesis. John Wiley, Hoboken (N.J.) 2005, ISBN 0-471-22854-0, S. 262–263.
- Eckhard Ottow, Ralph Rohde, Wolfgang Schwede, Rudolf Wiechert: Synthesis of 11β-(alkynyl)substituted 19-norsteroids. In: Tetrahedron Letters. 34, 1993, S. 5253–5256, doi:10.1016/S0040-4039(00)73966-9.