Fluoreszenzpolarisation
Werden Fluorophore mit linear polarisiertem Licht angeregt, so strahlen sie – bis auf wenige Ausnahmen – ebenfalls linear polarisiertes Licht ab. Diese Erscheinung wird Fluoreszenzpolarisation genannt.
Sind die Fluorophore beweglich und nicht fest im Raum angeordnet, so wird die Fluoreszenzpolarisation durch die Drehung der beweglichen Fluorophore beeinflusst, das heißt durch die Rotationsdiffusionskonstante: Die Lebenszeit des angeregten Zustandes, das heißt die Zeit zwischen Absorption eines Photons und Emission eines Photons, die sogenannte Fluoreszenzlebensdauer, ist zwar sehr klein – sie liegt im Nanosekunden-Bereich –, jedoch ist die durchschnittliche Rotationsgeschwindigkeit der beweglichen Fluorophore meist groß genug, dass sie Einfluss auf die gemessene Fluoreszenzpolarisation nimmt.
Bestimmung der Fluoreszenzpolarisation
Messtechnischer Grundaufbau
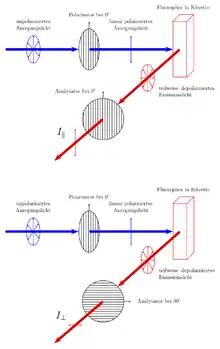
Das Anregungslicht wird mit einem Polarisator linear polarisiert und fällt dann auf die Probe. Das Emissionslicht wird mit einem zweiten Polarisator – dem Analysator – analysiert. Dazu wird die Intensität des Emissionslichtes bei zwei Stellungen des Analysators relativ zur Stellung des Polarisators gemessen:
- Stehen Polarisator und Analysator parallel zueinander, so wird die Fluoreszenzintensität parallel zur Ebene des Anregungslichtes gemessen. Diese Intensität – die parallele Strahlung – wird als bezeichnet.
- Stehen Polarisator und Analysator senkrecht zueinander, so wird die Fluoreszenzintensität senkrecht zur Ebene des Anregungslichtes gemessen. Diese Intensität – die perpendikuläre Strahlung – wird als bezeichnet.
Polarisation, Anisotropie, Gesamtintensität
Die Differenz D zwischen und wird als Maß für den Grad der Polarisierung des Emissionslichts verwendet.
Ist D gleich null, so ist die Rotationsgeschwindigkeit der untersuchten Fluorophore so schnell, dass sich innerhalb der Fluoreszenzlebenszeit des angeregten Fluorophors die Ausrichtungen der Fluorophore stochastisch verteilen: Es wird dann vollständig unpolarisiertes Emissionslicht gemessen.
Ist D gleich eins, so ist die Rotationsgeschwindigkeit der untersuchten Fluorophore so langsam, dass sich innerhalb der Fluoreszenzlebenszeit des angeregten Fluorophors die Ausrichtungen der Fluorophore nicht verändern: Die Polarisation des Anregungslichtes bleibt im Emissionslicht erhalten. Dazu muss allerdings das Emissionslicht im gleichen Winkel wie das Anregungslicht vom Fluorophor abgestrahlt werden. Das ist meistens nicht der Fall, das heißt, es gibt eine intrinsische Drehung des emittierten Lichtes zum absorbierten Licht durch das Fluorophor, auch wenn es nicht rotiert.
Die Differenz D wird stets mit einem Faktor normiert. Dabei haben sich zwei verschiedene Werte etabliert, die sich in ihrer Normierung unterscheiden: die Polarisation P und die Anisotropie A.
Die Polarisation P ist definiert als:
- .
Der Gewichtungsfaktor G ist ein separat zu bestimmender Gerätefaktor. Die gemessenen Werte für und weichen von den idealen Werten ab, da das Empfindlichkeitsverhältnis des Detektorsystems für parallele und perpendikuläre Strahlung unterschiedlich sein kann. Im idealen Fall ist G=1.
Die Anisotropie A ist definiert als:
- .
Die Gesamtintensität S ist definiert als:
- .
Der Gerätefaktor G lautet:
- .
Der G-Faktor wird vor der eigentlichen Messung anhand einer fluoreszenten Probe bestimmt. Die beiden Intensitäten und werden dabei genau gegenteilig wie die Intensitäten und bestimmt:
- Wird so bestimmt, dass der Polarisator bei 90° und der Analysator bei 0° steht, so wird bestimmt, wenn der Polarisator bei 0° und der Analysator bei 90° steht.
- Wird so bestimmt, dass der Polarisator bei 90° und der Analysator bei 90° steht, so wird bestimmt, wenn der Polarisator bei 0° und der Analysator bei 0° steht.
Zusammenhänge zwischen Polarisation und Anisotropie
Zwischen der Polarisation und der Anisotropie bestehen folgende Zusammenhänge:
Die Polarisation und die Anisotropie lassen sich also direkt ineinander umformen.
Heterogene Fluorophor-Populationen
Sind verschiedene Fluorophor-Populationen vorhanden, so wird eine Mischpolarisation bzw. eine Mischanisotropie gemessen.
Für die Mischpolarisation kann nach Gregorio Weber[1] folgender Zusammenhang geschrieben werden:
Dabei ist die Polarisation des iten Fluorophor-Population und der Anteil der iten Fluorophor-Population an der Gesamtintensität S:
- .
Wegen des Zusammenhanges zwischen Polarisation und Anisotropie, kann die Weber'sche Formel für die Mischanisotropie gebildet werden:
Ein spezieller Fall einer heterogenen Fluorophor-Population liegt vor, wenn eine Hintergrundintensität vom eigentlichen Messsignal abgezogen werden soll:
Dabei müssen die Intensitäten der parallelen und perpendikulären Strahlung des Hintergrundes in einer separaten Messung bestimmt werden.
Abhängigkeit der Fluoreszenzpolarisation von der Beweglichkeit des Fluorophors
Die Abhängigkeit der Fluoreszenzpolarisation von der Beweglichkeit des Fluorophors bei stationären Fluoreszenzmessungen wurde von Francis Perrin[2] 1926 aus der Theorie der Brownschen Molekularbewegung hergeleitet. Die nach ihm benannte Perrin-Gleichung beschreibt den Zusammenhang zwischen der gemessenen Polarisation, der Fluoreszenzlebensdauer und der Rotationsrelaxationszeit . Die Perrin-Gleichung lautet:
Dabei ist die intrinsische Polarisation des unbeweglichen Fluorophors.
Wegen des Zusammenhanges zwischen der Polarisation P und der Anisotropie A – und des Zusammenhangs zwischen der Rotationsrelaxationszeit und der Rotationskorrelationszeit – kann die Perrin-Gleichung umgeschrieben werden zu:
Dabei ist die intrinsische Anisotropie des unbeweglichen Fluorophors, analog zu .
Es wird meist folgende Darstellung der Perrin-Gleichung bevorzugt, da sie im Vergleich zur ursprünglichen Formulierung der Gleichung kompakter ist:
Die Fluoreszenzlebensdauer ist für jedes Fluorophor eine feste Stoffgröße, sofern es nicht zu dynamischen Quenching-Prozessen kommt. Wenn , das heißt, wenn die Fluorophore praktisch nicht mehr rotieren (zum Beispiel in einer hochviskosen Lösung), dann strebt der Quotient gegen eins, das heißt A wird gleich der intrinsischen Anisotropie A0. Wenn dagegen , das heißt die Rotation der Fluorophore ist unendlich schnell, dann strebt die Anisotropie A ebenfalls gegen 0. Weil und nur Werte größer gleich null annehmen können und wegen des linearen Zusammenhanges der Perrin-Gleichung, folgt, dass die Anisotropie A nur Werte zwischen null und der intrinsischen Anisotropie A0 annehmen kann. Analog gilt, dass die Polarisation P ebenfalls nur Werte zwischen null und der intrinsischen Polarisation P0 annehmen kann.
Für ein kugelförmiges Molekül in wässriger Lösung kann für die Rotationskorrelationszeit folgender Zusammenhang aufgestellt werden:
Dabei ist die Viskosität des Lösungsmittels, T ist die Temperatur, R ist die Gaskonstante und V ist das molekulare Volumen des Fluorophors. Aus der Perrin-Gleichung folgen bei diesen Bedingungen die generellen Zusammenhänge:
- Die Anisotropie A nimmt zu, wenn das Volumen des Fluorophors zunimmt.
- Die Anisotropie A nimmt zu, wenn die Viskosität des Lösungsmittels zunimmt.
- Die Anisotropie A nimmt ab, wenn die Temperatur zunimmt.
- Die Anisotropie A nimmt ab, wenn die Fluoreszenzlebensdauer zunimmt.
Literatur
- Joseph R. Lakowicz: Principles in Fluorescence Spectroscopy. 3. Auflage, Springer, 2006, ISBN 0-387-31278-1.
- Michel Daune: Molekulare Biophysik. Vieweg, 1997, ISBN 3-528-06689-X.
Referenzen
- Gregorio Weber: Polarization of the Fluorescence of Macromolecules. 1. Theory and experimental Method, Biochemical Journal, 51, 145–155, (1952).
- Francis Perrin: Polarisation de la Lumiére de Fluorescence. Vie Moyenne des Molécules dans L'Etat Exité, Journal de Physique, 7, No. 12, 390–401, (1926).