Elektrodialyse
Die Elektrodialyse (ED) (aus dem Griechischen dialysis = Auflösung) ist ein elektrochemisch getriebener Membranprozess (siehe Membrantechnik) in dem Ionenaustauschermembranen in Kombination mit einer elektrischen Potentialdifferenz benutzt werden, um ionische Spezies von ungeladenen Lösungsmitteln oder Verunreinigungen abzutrennen.
Funktionsprinzip
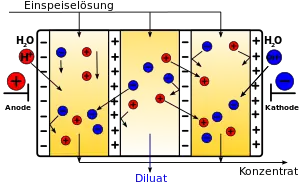

In einem Elektrodialyse-Separator wird der Raum zwischen zwei Elektroden durch einen Stapel aus einander abwechselnden Anionen- und Kationentauschermembranen getrennt. Jedes Paar Ionentauschermembranen bildet eine separate „Zelle“. In technischen Systemen bestehen diese Stapel aus mehr als zweihundert Membranpaaren. Wird eine elektrische Gleichspannung an die Elektroden angelegt, so wandern die Anionen zur Anode. Die Anionen können einfach die positiv geladenen Anionentauschermembranen passieren, aber sie werden jeweils an der nächstgelegenen negativ geladenen Kationentauschermembranen gestoppt. Weil dasselbe (natürlich mit umgekehrten Vorzeichen) auch mit den Kationen geschieht, besteht der Nettoeffekt der Elektrodialyse in einer Anreicherung der Salze in den Zellen mit ungerader Nummer (Anionentauschermembran/Kationentauschermembran), während die Zellen mit gerader Nummer (Kationentauschermembran/Anionentauschermembran) an Salz verarmen. Die Lösungen mit erhöhter Salzkonzentration werden zum Konzentrat vereint, während die salzarmen Lösungen das Diluat bilden.
Wegen der großen Anzahl von Zellen zwischen den Elektroden haben elektrochemische Elektrodenreaktionen praktisch keinen Einfluss auf den Energieverbrauch eines Elektrodialyse-Separators. Unter Berücksichtigung des Energieaufwandes für das Pumpen der Lösungen durch die Separator-Einheiten ist der Energieaufwand von Elektrodialyse-Trennungen proportional zur Salzkonzentration der Eingangslösung. Aus diesem Grund ist die Elektroosmose bei kleinen Salzkonzentrationen wirtschaftlicher als z. B. die Umkehrosmose. Zurzeit konkurriert das Elektrodialyseverfahren stark mit Umkehrosmosesystemen zur Entsalzung von Brackwasser. In Japan werden jährlich ca. 350.000 t Speisesalz mit Hilfe von Elektrodialyseanlagen produziert. Seewasser wird dabei von etwa 15 g/L auf 200 g/L Natriumchlorid-Gehalt angereichert, ehe man das Restwasser durch konventionelles Verdampfen entfernt. Eine Pilotanlage zur Entsalzung von Meerwasser in Singapur verarbeitet 50 Kubikmeter Wasser am Tag und braucht dabei pro Kubikmeter nur 1,5 Kilowattstunden elektrische Arbeit. Die bisher effizienteste Entsalzungstechnik, die Umkehrosmose, kostet mehr als doppelt so viel Energie. Mit sinkender Salzkonzentration wird der Prozess jedoch ineffizient, weil der elektrische Widerstand des Wassers zunimmt. Das letzte Prozent Salz extrahiert deshalb eine kontinuierliche Elektrodeionisation. Dabei nehmen Ionentauscherharze zwischen den Membranen die Ionen auf und transportieren sie weiter.[1]
Andere technisch realisierte Anwendungen der Elektrodialyse betreffen die Abwasserbehandlung, z. B. die Regeneration von Kupfer-Abscheidungsbädern bei der Produktion integrierter Schaltkreise. Käsemolke wird mittels Elektrodialyse demineralisiert und man entsalzt Dextranlösungen mit diesem Verfahren.
Der technische Einsatz von Elektrodialyseverfahren wird durch die begrenzte selektive Permeabilität derzeit vorhandener Ionentauschermembranen bei hohen Salzkonzentrationen eingeschränkt. Der Prozess wird unwirtschaftlich, sobald die Stromausnutzung 50–60 % unterschreitet. Dies geschieht bei den heutigen ionenselektiven Membranen, wenn die Salzkonzentration ca. 10–15 mol/L überschreitet.
Elektrodialyse mit Polumkehr
Diese Art der Elektrodialyse, kurz UED von Umkehr-Elektro-Dialyse oder englisch: Electrodialysis Reversal und abgekürzt EDR genannt - arbeitet mit einem regelmäßigen Wechsel der elektrischen Polarität der Membranen.[2] Hierdurch ist zwar der apparative Aufwand deutlich höher, aber durch die Polumkehr von Anode zur Kathode wird eine interne Reinigung der Membranen erreicht. Diese Reinigungswirkung wird erzielt, weil an der aktiven Kathodenoberfläche der Membranen der pH-Wert absinkt und an der Anodenoberfläche ansteigt. Die Bildung von Belägen wird dadurch auch bei leicht übersättigten Wässern unterdrückt.[3] Insbesondere bei der Erzeugung von Trinkwasser aus stärker salzhaltigen Rohwässern wird das EDR-Verfahren mit Erfolg eingesetzt.
Umkehrelektrodialyse
Die umgekehrte Elektrodialyse ist der Prozess, bei dem eine Salzlösung und Süßwasser durch einen Block sich abwechselnder Kathoden- und Anodenaustauschmembranen geleitet werden. Der Unterschied des chemischen Potentials zwischen Salz- und Süßwasser erzeugt einen Spannungsunterschied über jeder Membran. Das elektrische Gesamtpotential des Systems entspricht der Summe der Potentialunterschiede aller Membranen.[4]
Siehe auch
Literatur
- H. Strathmann: Electrodialysis and related processes. In: R. D. Noble, S. A. Stern (eds.), Membrane separations technology - Principles and applications, pp. 415–465, Elsevier, Amsterdam 1995.
- E. Korngold, K. Kock, H. Starthmann, Desalination 24, 129–139 (1978)
- H. Strathmann, B. Bauer, H. J. Rapp, CHEMTECH 1993, 17–24.
- R.Köhler, R. Brunner, WLB Wasser, Luft und Boden, 7–8/1991
Einzelnachweise
- IDW-Online: Entsalzung von Meerwasser
- Rudolf Kohler, Rudolf Brunner; Das Umkehrdialyse-Verfahren zur Wasser- und Abwasser-Entsalzung; in: WLB Wasser, Luft und Boden, 1991, Heft 7–8, S. 22–26
- Chr. von Oppel; Wasserentsalzung mit elektrochemischen Membranverfahren; in: VGB Kraftwerkstechnik, Jg. 66, 1986
- Universität Twente: Power generation by reverse electrodialysis (Memento des Originals vom 27. September 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. August 2007