CT-geführte, interstitielle Brachytherapie
Die CT-geführte, interstitielle Brachytherapie ist eine spezielle Unterform der Brachytherapie.
Definition
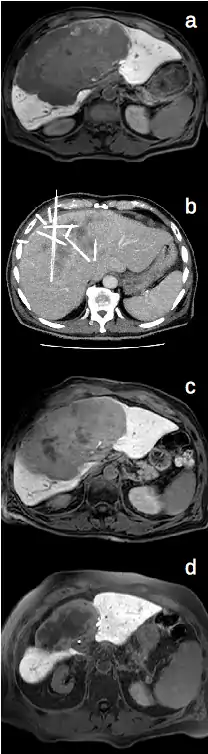
Die bildgeführte interstitielle HDR (High-Dose-Rate) Brachytherapie in Afterloadingtechnik ist eine Therapiemöglichkeit verschiedener maligner Erkrankungen[1]. Der Schwerpunkt der CT-geführten Brachytherapie liegt in der minimalinvasiven Behandlung primärer und sekundärer Tumoren der Leber[2], Lunge[3], Nieren und Nebennieren[4] sowie Lymphknoten[5]. Zu den häufigsten Tumorerkrankungen zählt hierbei das hepatozelluläre Karzinom, cholangiozelluläre Karzinom und Nierenzellkarzinom sowie Metastasen des kolorektalen Karzinoms, Mammakarzinoms, Nierenzellkarzinoms, Bronchialkarzinoms sowie neuroendokriner Tumoren.
Angewendet werden kann die bildgeführte Brachytherapie einzeln oder als Ergänzung zu systemischer Chemotherapie/Immuntherapie und Chirurgie. Verwandte Verfahren in der interventionellen lokalablativen Therapie sind die Radiofrequenzablation, Mikrowellenablation und Laserablation sowie im weiteren Sinne die transarterielle Chemoembolisation und Radioembolisation.
Wirkungsweise
Die Wirkung der interstitiellen Brachytherapie beruht auf einer einmaligen Hochdosisbestrahlung, welche die Abtötung aller erfassten Tumorzellen zum Ziel hat. Aufgrund der physikalischen Gegebenheiten fällt die Dosis zur Umgebung hin sehr steil ab, umgebendes gesundes Gewebe kann daher geschont werden.
In Abhängigkeit von der Tumorart mit seiner jeweiligen Strahlensensibilität beträgt die Zieldosis um den Tumor 15 – 25 Gray, hiermit kann in den meisten Fällen eine Ablation erreicht werden.
Indikationen
Entsprechend der Wirkungsweise kann die CT-geführte Brachytherapie grundsätzlich bei allen Formen solider Tumoren und deren Metastasen angewendet werden. Typischerweise erfolgt die Behandlung, wenn eine chirurgische Entfernung klinisch oder technisch nicht möglich ist sowie häufig ergänzend zu einer Chemotherapie oder wenn sich diese nicht mehr als wirksam erweist.
Seit 2016 wurde die bildgeführte Brachytherapie in die Europäische Leitlinie zum therapeutischen Management des metastasierten kolorektalen Karzinoms aufgenommen und wird in dieser gleichrangig mit anderen minimalinvasiven Verfahren zur Therapie nicht resektabler Metastasen aufgeführt[6].
Im Falle des hepatozellulären Karzinoms kann die Anwendung alternativ oder ergänzend zur transarteriellen Chemoembolisation üblicherweise im Erkrankungsstadium BCLC B erfolgen. Weiterhin wird die bildgeführte Brachytherapie als Alternative zur Radiofrequenzablation oder transarteriellen Chemoembolisation bei der Bridgingbehandlung bis zur Lebertransplantation diskutiert[7].
Therapieablauf
Die Anlage der Bestrahlungskatheter in die zu behandelnden Tumoren erfolgt zunächst über eine Punktion von außen, welche mit Hilfe der Computertomographie (seltener auch Magnetresonanztomographie oder Sonographie) durchgeführt wird. Hierbei erfolgt eine Lokalanästhesie im Bereich der Einstichstelle sowie zusätzliche Analgosedierung mit der Gabe von Schmerz- und Beruhigungsmitteln.
Nach Anlage und Befestigung der Bestrahlungskatheter wird der Patient in die Strahlentherapie verbracht und dort erfolgt über die Katheter die Hochdosisbestrahlung der Tumoren von innen mit einer Iridium-192-Quelle.
Nach Abschluss der Bestrahlung werden die Strahlenquelle sowie im Anschluss die Katheter vollständig entfernt.
Nebenwirkungen und Limitationen
Akute Komplikationen stehen typischerweise im Zusammenhang mit der Anlage der Katheter. Wie bei anderen bildgeführten Punktionsverfahren können Blutungen, Infektion oder Gewebeschäden auftreten. Chronische Schädigungen gehen auf die Strahlenwirkung zurück und betreffen sowohl das Zielorgan als auch strahlensensible Nachbarorgane wie Magen oder Darm, deren Nähe gelegentlich die applizierbare Strahlendosis begrenzen können.
Einzelnachweise
- Tina Bretschneider, Jens Ricke, Bernhard Gebauer, Florian Streitparth: Image-guided high-dose-rate brachytherapy of malignancies in various inner organs - technique, indications, and perspectives. In: Journal of Contemporary Brachytherapy. Band 8, Nr. 3, Juni 2016, ISSN 1689-832X, S. 251–261, doi:10.5114/jcb.2016.61068, PMID 27504135, PMC 4965506 (freier Volltext).
- Jens Ricke, Peter Wust: Computed tomography-guided brachytherapy for liver cancer. In: Seminars in Radiation Oncology. Band 21, Nr. 4, Oktober 2011, ISSN 1532-9461, S. 287–293, doi:10.1016/j.semradonc.2011.05.005, PMID 21939858.
- J. Ricke, P. Wust, S. Hengst, G. Wieners, M. Pech: [CT-guided interstitial brachytherapy of lung malignancies. Technique and first results]. In: Der Radiologe. Band 44, Nr. 7, Juli 2004, ISSN 0033-832X, S. 684–686, doi:10.1007/s00117-004-1077-x, PMID 15221154.
- K. Mohnike, K. Neumann, P. Hass, M. Seidensticker, R. Seidensticker: Radioablation of adrenal gland malignomas with interstitial high-dose-rate brachytherapy: Efficacy and outcome. In: Strahlentherapie Und Onkologie: Organ Der Deutschen Rontgengesellschaft … [et Al]. Band 193, Nr. 8, August 2017, ISSN 1439-099X, S. 612–619, doi:10.1007/s00066-017-1120-2, PMID 28341865.
- F. Collettini, A. C. Schippers, D. Schnapauff, T. Denecke, B. Hamm: Percutaneous ablation of lymph node metastases using CT-guided high-dose-rate brachytherapy. In: The British Journal of Radiology. Band 86, Nr. 1027, Juli 2013, ISSN 1748-880X, S. 20130088, doi:10.1259/bjr.20130088, PMID 23659925, PMC 3922177 (freier Volltext).
- E. Van Cutsem, A. Cervantes, R. Adam, A. Sobrero, J. H. Van Krieken: ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. In: Annals of Oncology: Official Journal of the European Society for Medical Oncology. Band 27, Nr. 8, August 2016, ISSN 1569-8041, S. 1386–1422, doi:10.1093/annonc/mdw235, PMID 27380959.
- Timm Denecke, Lars Stelter, Dirk Schnapauff, Ingo Steffen, Bruno Sinn: CT-guided Interstitial Brachytherapy of Hepatocellular Carcinoma before Liver Transplantation: an Equivalent Alternative to Transarterial Chemoembolization? In: European Radiology. Band 25, Nr. 9, September 2015, ISSN 1432-1084, S. 2608–2616, doi:10.1007/s00330-015-3660-0, PMID 25735513.