Bananenbindung
Eine Bananenbindung (engl. banana-bond) ist eine Sonderform der kovalenten Atombindung. Sie kommt vor allem in ringförmigen Molekülen vor und wird exakt durch Molekülorbital-Modelle beschrieben.

Bei normalen Einfachbindungen überlappen zwei Elektronenwolken (Atomorbitale), so dass das entstehende Molekülorbital auf der Bindungsachse liegt. Dies garantiert maximale Überlappung und damit den größten Energiegewinn. Weil der kleinste mögliche Winkel zwischen zwei Atomorbitalen 90° beträgt, kann diese Anordnung aufgrund geometrischer Zwänge unmöglich sein. In einem solchen Fall kann das bindende Elektronenpaar die Bindungsachse überspannen. Die Form der Bindung erinnert dann an eine Banane. Weil die Bindungselektronendichte nicht in der Achse zwischen den beiden verbundenen Atomen liegt, ist die Orbitalüberlappung nicht optimal und die Bindung daher schwächer. Dies führt dazu, dass Verbindungen mit Bananenbindungen instabiler und viel reaktiver sind. Dies äußert sich auch in einer im Vergleich zu isomeren Verbindungen größeren Verbrennungswärme.
Beispiele für Bananenbindungen
Cyclopropan

Das einfachste Beispiel einer Bananenbindung ist beim Cyclopropan C3H6 zu finden. Das Molekül ist ein Ring, der aus drei Atomen besteht. Daraus ergäbe sich ein Bindungswinkel von 60°. Da aber die Elektronenwolken in einem sp³-hybridisierten C-Atom ungefähr in einem 109° Winkel angeordnet sind, ist keine gestreckte Anordnung bei der Bindung möglich. Die sp³ Hybridorbitale sind jeweils um etwa 25° aus der Bindungsachse gedreht. Eine bessere Näherung liefert das Walsh-Modell, das von sp² hybridisierten Kohlenstoffen ausgeht.
Ethen

Für C=C-Doppelbindungen werden zwei Modelle diskutiert. Linus Pauling beschreibt Doppelbindungen als aus zwei gleichwertigen Bindungen bestehend, den oben vorgestellten Bananenbindungen.[1] Erich Hückel schlägt dagegen vor, dass sie sich aus einer sigma- und einer pi-Bindung zusammensetzt.[2] Welche Erklärung die bessere ist, ist noch nicht abschließend geklärt, obwohl einige theoretische Chemiker beide Darstellungen als äquivalent ansehen.
Diboran
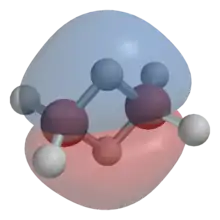
Bei der Verbindung Diboran (B2H6) ist ein spezieller Fall einer Bananenbindung zu finden. Es handelt sich um eine 2-Elektronen-3-Zentren-Bindung. Die zwei Elektronen befinden sich in einem Molekülorbital, das über drei Atome delokalisiert ist.
Einzelnachweise
- Linus Pauling: The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules. J. Am. Chem. Soc. 1931, 53 1367–1400.
F. Weinhold, Clark R. Landis: Valency and Bonding: A Natural Bond Orbital Donor-Acceptor Perspective, Cambridge University Press, 2005, ISBN 0-52183128-8. - E. Hückel: Z. Phys 1930, 60, 423.; Penney, W. G. Proc. R. Soc. London 1934, A144, 166; A146, 223.