Agabus bipustulatus
Agabus bipustulatus ist ein Käfer aus der Familie der Schwimmkäfer. Die Gattung Agabus ist in Europa durch drei Untergattungen repräsentiert. Agabus bipustulatus gehört zur Untergattung Gaurodytes, die in Europa mit neunundzwanzig Arten vertreten ist.[1] Agabus bipustulatus ist ein häufiger und weit verbreiteter Käfer. Neuere Arbeiten zeigen, dass die Trennung der Arten Agabus bipustulatus und Agabus solieri vermutlich nicht gerechtfertigt ist.[2][3]
| Agabus bipustulatus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Agabus bipustulatus ♂ | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Agabus bipustulatus | ||||||||||||
| (Linnaeus, 1767) |
Bemerkungen zum Namen
Die Art wurde erstmals 1767 von Carl von Linné unter dem Namen Dytiscus bipustulatus beschrieben. Die Beschreibung enthält den Satz capite postice punctis duobus rubris (lat. am Hinterkopf mit zwei roten Punkten).[4] Die naheliegenden Artnamen bipunctatus (mit zwei Punkten) und bimaculatus (mit zwei Flecken) waren innerhalb der Gattung Dytiscus in seiner damaligen Abgrenzung bereits vergeben, bimaculatus bereits 1764 durch O. F. Müller,[5] bimaculatus von Linné selbst in der gleichen Ausgabe unter der Nummer 21.[4] So wich Linné auf den Artnamen bipustulatus (lat. mit zwei Pusteln)[6] aus. Die beiden roten Punkte können auch undeutlich sein oder fehlen. Auch gibt es verwandte Arten, die ebenfalls am Hinterkopf zwei rote Flecken tragen. Der Name der Untergattung Gaurodytes leitet sich von altgr. γαύρος „gāūros“ für „prächtig“ und δύτης „dýtes“ für „Taucher“ ab.[7] Der Gattungsname Agabus gehört zu den Namen, die nicht auf Eigenschaften der benannten Tiere Bezug nehmen, sondern lediglich einen in der Antike gebräuchlichen Personennamen darstellen.[7] Die Art wurde auch unter mehreren Synonymen beschrieben.
.jpg.webp) Abb. 1: Männchen von oben
Abb. 1: Männchen von oben Abb. 2: Weibchen von oben
Abb. 2: Weibchen von oben Abb. 3: Unterseite (Weibchen)
Abb. 3: Unterseite (Weibchen) Abb. 4a: Aufsicht Kopf
Abb. 4a: Aufsicht Kopf Abb. 4b: Aufsicht Kopf
Abb. 4b: Aufsicht Kopf Abb. 5: Kopf seitlich
Abb. 5: Kopf seitlich Abb. 6: Seitenansicht
Abb. 6: Seitenansicht Abb. 7: Vorderansicht
Abb. 7: Vorderansicht Abb. 8: Ausschnitt Unterseite (siehe Text)
Abb. 8: Ausschnitt Unterseite (siehe Text) Abb. 9: Hintertarsus
Abb. 9: Hintertarsus Abb. 10: Klauenglied Hinterbein
Abb. 10: Klauenglied Hinterbein Abb. 11: Hinterschenkel, rechts Gelenk zur Schiene, davor Gruppe aus kurzen Borsten
Abb. 11: Hinterschenkel, rechts Gelenk zur Schiene, davor Gruppe aus kurzen Borsten Abb. 12a: Vordertarsus ♀ Innenseite
Abb. 12a: Vordertarsus ♀ Innenseite Abb. 12b: Vordertarsus ♂ Innenseite
Abb. 12b: Vordertarsus ♂ Innenseite Abb. 13: Klauenpaar Vordertarsus ♂ von oben, Innenklaue grün getönt
Abb. 13: Klauenpaar Vordertarsus ♂ von oben, Innenklaue grün getönt
Eigenschaften des Käfers
Der Käfer hat die für Schwimmkäfer typische flache länglich ovale Form, die Hinterbeine sind ruderförmig als Schwimmbeine ausgebildet. Der Käfer erreicht eine Länge von acht bis elf Millimeter. Die Männchen (Abb. 1) sind an den verdickten Tarsen der Vorderbeine zu erkennen (Abb. 12 rechts), an denen jedoch Saugnäpfe fehlen. Die Oberseite ist bei den Weibchen (Abb. 2) matt mit zartem Seidenglanz, bei den Männchen glänzend. Der schwarzbraune Käfer hat rotbraune Fühler, Taster und Vordertarsen.
Der Vorderrand der Augen ist in Nähe der Fühler eingerückt (Abb. 5). Die Fühler sind fadenförmig und elfgliedrig. Am Hinterrand des Kopfes befinden sich einander genähert zwei quer liegende Bereiche, an denen die Farbe rötlich aufgehellt ist (Abb. 4a). Diese sind für die Art namensgebend. Sie werden mehr oder weniger vom Halsschild verdeckt, wenn der Käfer den Kopf hebt. Häufig sind sie auch sehr schwach ausgebildet oder fehlen ganz (Abb. 4b).
Der Halsschild ist an der Basis am breitesten und dort so breit wie die Flügeldecken vorn. Die Halsschildseitenrandlinie läuft an den Vorderecken aus und setzt sich nicht nach innen fort (Abb. 6 bei Vergrößerung). Die Punktreihe am Vorderrand des Halsschilds ist in der Mitte nicht breit unterbrochen (Abb. 4a und b). Das Schildchen ist gut sichtbar.
Die Flügeldecken zeigen wie der Halsschild eine netzförmige Struktur mit stark gestreckten, überwiegend längs verlaufenden Maschen (Abb. 4b). Innerhalb der Maschen ist die Oberfläche chagriniert. Die Punktreihen der Flügeldecken werden aus mittelgroßen und länglichen, isoliert stehenden Punkten gebildet. Die untergeschlagenen Teile der Deckflügel (Epipleuren) verjüngen sich nach hinten plötzlich stark und laufen schon auf der Höhe des zweiten Hinterleibssegments aus (Abb. 8, Epipleuren rechts rot getönt, Zahlen 1 und 2 sind Nummern der Hinterleibssegmente).
Die Tarsen sind alle fünfgliedrig. Bei den Männchen sind die basalen drei Glieder der Vordertarsen verdickt und filzig besohlt (Abb. 12b). Die äußere Vorderklaue des Männchens ist lappenförmig stark verlängert, dachartig gewölbt und seitlich verwunden (Abb. 13), die innere Vorderklaue (in Abb. 12b und in Abb. 13 grün getönt) trägt an der Basis einen deutlichen Zahn. Beim Weibchen sind die innere und äußere Klaue der Vordertarsen gleich ausgebildet (Abb. 12a). In beiden Geschlechtern sind die Hintertarsen schlank, das zweite bis vierte Glied mindestens doppelt so lang wie breit (Abb. 9). Die äußere und innere Hinterkralle sind gleich lang (Abb. 10). Die beiden Enddorne der Hinterschienen sind kürzer als das erste Tarsenglied (Abb. 9). Die Hinterschenkel tragen an der äußeren Ecke des Hinterrandes eine Gruppe von Borsten (von unten gut sichtbar, Abb. 11). Die Seitenlinien der Hinterhüften sind nach vorn nicht fast erloschen, sondern gehen deutlich in den Hinterrand der Hinterbrust über, wobei sie sich nach außen erweitern (Abb. 8 links Hinterhüfte gelb getönt). Die Seitenausläufer der Hinterbrust (in Abb. 8 Hinterbrust grün getönt) sind nicht schmal, sondern breit dreieckig.
Larve
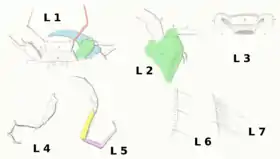
det, rechts teilweise koloriert; a Unterlippe b Kinn, grün: Stipes des Unterkiefers, rot: Lippentaster;
Abb. L2: Vergrößerter Ausschnitt des Stipes (a) mit dem Fortsatz nach vorn (b) und der mala ex-
terior (c) d: Wurzel des Kiefertasters; Abb. L3: Epistom und Oberlippe von unten: a: Stirnhöcker
des Epistoms (anguli frontales), b: Oberlippe, grau: Mundraum mit zwei Kanälen, die unterhalb
der Stirnhöcker austreten; Abb. L4: Behaarung des Vorderbeins; Abb. L5: Behaarung des Hinter-
beins, Schenkel gelb, Schiene pink; Abb. L6: Ausschnitt Behaarung am Innenrand des Schen-
kels des Hinterbeins; Abb. L7: Ausschnitt Behaarung am Innenrand der Schiene des Hinterbeins[8]
Die Larve von Agabus bipustulatus wurde 1901 von dem Dänen Frederik Meinert beschrieben.[8] Die Larve zeigt die für die Schwimmkäferlarven typische längliche Gestalt mit einem rundlichen flachen (linsenförmigen) Kopf, dem Brustabschnitt mit drei Paaren langer Beine und dem Hinterleib aus acht Segmenten, wobei das letzte Segment ein Paar zweigliedriger Cerci trägt.[9] Es gibt drei verschiedene Larvenstadien, wobei das erste Larvenstadium stärker von den beiden älteren Larvenstadien abweicht als diese voneinander. Die folgenden Angaben gelten für das dritte Larvenstadium. Die Larve wird im letzten Stadium dreizehn Millimeter lang. Sie ist braun, der Hinterrand der Körpersegmente dunkelbraun. Auf dem Kopf befinden sich mehrere helle Flecken, auf den Rückenschildern Reihen von vier schmalen aufgehellten Flecken. Die Larve ist fast kahl, nach hinten teilweise kurz behaart.
Am Kopf bilden auf jeder Seite sechs Einzelaugen ein Augenfeld. Die Einzelaugen sind in zwei hintereinander liegenden vertikalen Reihen mit je drei Ozellen angeordnet. Von oben sind vier Einzelaugen sichtbar, von unten zwei. Hinter dem Augenfeld und vor dem Hals liegt die Schläfenregion. In ihr entspringen nahe dem Hals seitlich drei oder vier kurze Stacheln, die in einer Längsreihe stehen und eine Art Kamm bilden (aculei temporales). Die viergliedrigen Fühler sind kahl und ohne Anhänge. Das erste und zweite Fühlerglied sind gleich lang, jedes doppelt so lang wie das vierte und nur wenig länger als das dritte. Den Abschluss des Kopfes nach vorn bildet eine Region, deren Oberseite der Clypeus und deren Unterseite die untergeschlagene Oberlippe bildet. Am Vorderrand dieser Region liegen quer zwei Reihen aus sehr kurzen, platten und nach vorn abstehenden Härchen, die auch Lamellen oder ruderförmige Haare genannt werden (in Abb. L3 von unten gesehen ist nur eine Reihe am Rand der Oberlippe zu sehen). Die beiden Oberkiefer (in Abb. L1 rechts blau) sind relativ kurz und nach innen gebogen. Sie tragen wie bei allen Schwimmkäfern auf der Innenseite eine tiefe Furche, durch die die flüssige oder verflüssigte Nahrung zur Mundöffnung abfließen beziehungsweise abgesaugt werden kann (äußerer Teil des canalis cibarius). Die Mundhöhle ist geschlossen. Von ihr verlaufen zwei Kanäle (innerer Teil der canalis cibaris) seitlich nach vorn und münden auf der Unterseite der Stirnhöcker (anguli frontales, Abb. L3 a). Bei der Nahrungsaufnahme sind die Oberkiefer so weit geöffnet, dass die basale Öffnung des Nahrungskanals auf diese Mündungen zu liegen kommen. Der Stipes der Unterkiefer (in Abb. L1 rechts grün und vergrößert ausschnittsweise Abb. L2 a) hat eine Verlängerung nach vorn (Abb. L2 b), an der nach innen ein zapfenförmiger Fortsatz entspringt, den Maenert mala exterior nennt (Abb. L2 c). Darunter liegen auf der Innenseite zwei hakenförmig gekrümmte Fortsätze. Links der Verlängerung des Stipes (außen) sitzt die Wurzel des Kiefertasters. Dieser ist schlank und dreigliedrig, sein erstes und drittes Glied sind gleich lang, das zweite Glied etwas länger. Die Unterlippe (Abb. L1 a) ist zweieinhalb mal so breit wie lang. Die an den Vorderecken der Unterlippe entspringenden Lippentaster bestehen aus zwei schlanken Gliedern, das Endglied ist weniger als halb so lang wie das Basisglied.
Die Larven der Arten werden auch durch die Längenverhältnisse der letzten Hinterleibssegmente und der zweigliedrigen Cerci charakterisiert. Bei Agabus bipustulatus ist das achte Abdominalsegment etwas weniger als doppelt so lang wie das siebte (13:7), das Basisglied der Cerci ist minimal länger als das achte Abdominalsegment, das Endglied der Cerci ist fast vollständig rückgebildet und wenig deutlich abgesetzt. Die Cerci sind nahezu kahl. An der Basis des Endglieds entspringen vier kurze Haare, die das Endglied um ein Vielfaches überragen. Nahe der Basis der Cerci befinden sich beiderseits drei weitere, längere Haare.
Die sechsgliedrigen Beinen (Hüfte, Schenkelring, Schenkel, Schiene, Tarsus, Klauen) sind auf charakteristische Art behaart. Die Behaarung des Vorderbeins von Agabus bipustulatus zeigt Abb. L4, die Behaarung des Hinterbeins Abb. L5 (Schenkel gelb getönt, Schiene pink getönt). Die vergrößerten Ausschnitte zeigen die Behaarung des Hinterbeins am Innenrand des Schenkels (Abb. L6) und am Innenrand der Schiene (Abb. L7).
Junglarve, zweites Larvenstadium und Altlarve unterscheiden sich am auffälligsten durch die Längenverhältnisse der Körperteile und die Färbung. Beispielsweise erreichen bei der Altlarve die ausgestreckten Hinterbeine kaum das 7. Abdominalsegment, während sie im 2. Stadium das 8. Segment erreichen und bei der Junglarve das Ende der Hinterleibs deutlich überragen. Der Kopf ist nur bei der Junglarve nahezu schwarz. Aber auch weniger auffällige Merkmale sind bei den verschiedenen Larvenstadien verschieden ausgebildet, beispielsweise besitzen nur die Junglarve Eizähne und noch keine Stacheln in der Schläfenregion, das zweite Larvenstadium besitzt mehr solche Stacheln in der Schläfenregion als die Altlarve. Das zweite Glied der Cerci ist im 2. Stadium noch deutlich ausgebildet.[10][11]
Eier und Puppe

Frisch abgelegte Eier sind schlank, blassgelb, 1,4 Millimeter lang und weniger als halb so breit. Ältere Eier sind bräunlich, größer und rundlicher. Die Puppe erreicht eine Länge von acht bis neun Millimeter bei einer Breite von fünf Millimeter. Sie ist weißgelb und zeigt gegenüber anderen Schwimmkäferpuppen keine Besonderheiten.[11] Abb. P zeigt eine Agabus-Puppe aus einer Veröffentlichung von 1865, ein Link zum Foto einer Puppe der Gattung findet sich bei den Einzelnachweisen.[12]
Biologie
Lebensraum
Die erwachsenen Tiere sind zumindest in Mitteleuropa ganzjährig zu finden. Die Eier werden im Wasser abgelegt. Die Larven entwickeln sich im Wasser und leben wie die fertigen Käfer räuberisch. Sie ernähren sich dabei hauptsächlich von kranken, geschwächten Tieren, hauptsächlich Mückenlarven. Sie stellen zusammen mit anderen Schwimmkäfern ein wichtiges Glied der aquatilen Gesundheitspolizei dar.[13] Die Art kommt in fast allen Wassertypen vor, sie gehört bezüglich der Biotopwahl zur Gruppe der Generalisten. Oberhalb der Baumgrenze findet man sie in flachen Seen mit steinigem bis schlammigem Untergrund. In der Bergregion findet man den Käfer in kleinen Rinnsalen, Quellen und Tümpeln mit oder ohne Vegetation. Im Flachland werden die verschiedensten Gewässer besiedelt, von temporären Gewässern wie Pfützen oder wassergefüllten Fahrrinnen bis zu Brackwasserzonen und Torfmooren, Viehtränken und Gartenteichen.[14] Im Unterschied zu anderen Wasserkäfern kann Agabus bipustulatus beim Austrocknen der Gewässer im Sommer noch monatelang im feuchten umgebenden Erdreich verbleiben und zieht sich erst beim völligen Austrocknen in permanente Gewässer zurück. Bei einer Vergleichsstudie erwies sich die Wahrscheinlichkeit des Auftretens der Art in Biotopen mit einer Nassphase von drei bis vier Monaten größer als bei Gewässern mit längerer oder kürzerer Nassphase.[15] Neu geschaffene Biotope werden sehr schnell besiedelt. Es werden jedoch stehende Gewässer oder träge fließende Abschnitte in fließenden Gewässern mit reichlich Pflanzenbewuchs und einem Bodensatz von in Zersetzung befindlichen Pflanzen bevorzugt. Dort findet auch die Fortpflanzung statt.[11] Die Käfer zeigen eine gut entwickelte Flugmuskulatur und sind gute Flieger, die von Licht angezogen werden.[16]
Paarung
Die Hauptzeit der Fortpflanzung liegt in Mitteleuropa im Spätherbst, man kann Kopulationen jedoch bis ins Frühjahr beobachten. Trotz der spezialisierten Vordertarsen des Männchens hat dieses Mühe, das Weibchen festzuhalten. Das Weibchen entkommt leicht, wenn es sich an Wasserpflanzen festhalten kann. Das Männchen versucht deswegen, das Weibchen ins freie Wasser zu drängen. Das Männchen strebt die bei der Atmung an der Wasseroberfläche eingenommene Körperhaltung an, da ihm die Adhäsion an die Wasseroberfläche eine gewisse Stabilität verleiht. Kann das Männchen diese Stellung erreichen, während er das Weibchen festhält, gibt dieses gewöhnlich bald den Widerstand auf. Das Männchen versucht sich und das fixierte Weibchen durch abwechselndes Beugen und Strecken der letzten Hinterleibsringe in eine Schaukelbewegung zu versetzen. Diese scheint das Weibchen zu stimulieren. Die Schaukelbewegung wird gelegentlich durch ein heftiges Zittern in horizontaler Richtung unterbrochen, welches durch das schnelle Schlagen der Hinterleibsspitze vom Männchen ausgelöst wird. Im Anschluss an dieses Zittern tritt der säbelartige Penis des Männchens aus und sucht die weibliche Geschlechtsöffnung zu erreichen. Das Übertragen des Spermas in einer Spermatophore scheint nur zu gelingen, wenn das Weibchen durch Vorstrecken der Hinterleibsspitze dem Männchen im ursprünglichen Wortsinn entgegenkommt und damit den Weg zur Scheide frei gibt.[17]
Eiablage und Embryonalentwicklung
Frisch begattete Weibchen sind daran zu erkennen, dass die Spitze der durch das Männchen eingebrachten drei Millimeter langen Spermatophore in Form eines einen Millimeter langen, durchsichtigen Gallertstreifens noch an der Spitze des Hinterleibs sichtbar ist. Nachdem die hellgelbe Spermamasse aus der Spermatophore in Richtung auf den Samenbehälter des Weibchens ausgewandert ist, stößt das Weibchen wenige Stunden nach der Trennung vom Männchen die Reste der Spermatophore und damit auch den äußerlich sichtbaren Teil ab. Die Eiablage erfolgt ebenfalls von Herbst bis Frühjahr, wird aber bei niederen Temperaturen unterbrochen. In pflanzenlosen Aquarien werden die Eier frei ins Wasser abgegeben oder seltener locker an die Wände und an den Boden geklebt. In der Natur findet man die Eier an lebendem oder totem Pflanzenmaterial verschiedenster Pflanzengattungen angeheftet. Bevorzugt werden Triebspitzen, wobei die Eier, ohne das Gewebe zu verletzen, tief zwischen die jüngsten Blätter des Vegetationskegels geschoben werden und dort mit einer Masse, die schnell härtet, angeklebt werden. Die anfänglich 1,4 Millimeter langen Eier vergrößern sich erheblich und werden weniger schlank. Das Chorion platzt und die Dotterhaut wird zur Eihülle. Die Eier werden dabei 1,75 Millimeter lang und 0,95 Millimeter dick. Die Embryonalentwicklung dauert bei sechs bis sieben Grad Celsius sechs bis sieben Wochen. Dabei ist zuerst die Pigmentierung der Einzelaugen, dann die Bräunung der Oberkiefer zu beobachten.
Larvenstadien
Frisch geschlüpfte Larven messen ohne Cerci drei Millimeter. Die Tiere dunkeln innerhalb weniger Stunden, die Kopfkapsel wird schwarzbraun. Der Verschluss der anfangs noch offenen Mundspalte erfolgt durch Umklappen der Oberlippe nach unten und hinten. Die Junglarve kann unter paddelnden Bewegungen kurze Strecken frei schwimmen, bewegt sich gewöhnlich jedoch auf den Wasserpflanzen kriechend fort. Dabei bewegt sich erst das Vorderbein, dann das Mittelbein der Gegenseite und schließlich das Hinterbein der Ausgangsseite. Haben die drei Beine Halt gefunden, dann erfolgt der gleiche Ablauf spiegelbildlich an der anderen Körperhälfte. Der Hinterleib berührt dabei die Unterlage nicht. Die langen Krallen ermöglichen eine gute Verankerung auf der Unterlage. Die Larven halten sich bevorzugt im dichten Wassergrasrasen der Uferzonen auf. Hier verharren sie oft stundenlang bewegungslos nahe der Wasseroberfläche. Jagende Larven kriechen eidechsenartig umher. Wenn sie auf ein Gegenüber treffen, können sie zurückschrecken und fliehen. Fühlen sie sich dagegen dem Gegenüber gewachsen, schlagen sie die Mandibeln energisch in den Gegner, selbst in körperlich größere Artgenossen. Nach einem Fehlbiss zieht sich die Larve schnell zurück, um sich erst nach einiger Zeit wieder vorsichtig der Beute zu nähern. Bei 12 °C dauert die Verarbeitung eines gleichaltrigen Artgenossen etwa eine halbe Stunde. Im Freiland finden sich Junglarven von Dezember bis April, bei höheren Temperaturen kann jedoch bereits nach elf Tagen die Häutung zur Larve des zweiten Stadiums stattfinden. Diese wächst von anfangs 5,5 Millimeter auf acht Millimeter. Sie ist nicht mehr schwimmfähig und bewegt sich schwerfälliger, beim Kriechen schleift das Körperende auf dem Untergrund. Als Beute dienen hauptsächlich Fliegenlarven, gelegentlich auch schon Kaulquappen und gehäuft Junglarven der gleichen Art. Die nächste Häutung erfolgt bei rund 18 °C nach sieben Tagen, bei Temperaturen um 12 °C bis 15 °C nach 10 Tagen. Die Altlarve gleicht in der Färbung dem zweiten Larvenstadium. Sie wächst von knapp elf Millimeter auf vierzehn bis siebzehn Millimeter an, die Größenzunahme bezüglich des zweiten Stadiums beträgt fast sechzig Prozent. Das Bedürfnis nach atmosphärischer Luft ist bedeutend größer, die Bewegungen noch schwerfälliger. Dadurch ändern sich auch die potenziellen Beutetiere. Nach der Mahlzeit kann man manchmal Putzbewegungen beobachten, bei denen die Vorderbeine mehrmals von hinten nach vorn über den Kopf gezogen werden. Die Dauer des dritten Larvenstadiums hängt von der Temperatur und vom Nahrungsangebot ab. Die meisten Altlarven überwintern. Sie finden sich bereits im Januar zahlreich, sind jedoch bis April anwesend, bei kälteren Klimaten wohl auch noch im Mai. Ein völliges Einfrieren ist tödlich, auch wenn dies nur zwölf Stunden dauert und die Larve dabei nicht auf die Gefriertemperatur abgekühlt wird. Ein teilweises Einfrieren jedoch überlebt die Larve, selbst wenn nur ein kleiner Teil des Tiers eisfrei bleibt.
Verpuppung, Bau der Puppenwiege
Die ausreichend gealterte Altlarve stellt die Nahrungsaufnahme ein und beginnt unruhig umherzuwandern. In den Nachtstunden versucht sie ans Land zu gelangen. Dort bewegt sie sich geschickter als im Wasser und kann auch erhebliche Hindernisse überwinden. Dann gräbt sich die Larve zur Verpuppung ein und baut eine Hohlkugel aus Erde von acht bis zwölf Millimetern lichter Weite und einer Wandstärke von drei Millimetern. Dieses Gehäuse ist bis zur Hälfte oder zwei Dritteln in den umgebenden Boden eingesenkt, mit diesem höchstens leicht verwoben und größtenteils von einer Luftwand umgeben. Ältere, ausgetrocknete Gehäuse sind leicht aus dem Boden zu lösen. Zur Herstellung krümmt die Larve auf einem geeigneten Untergrund den Hinterleib nach oben und vorn, bis die Leibesspitze den Kopf berührt. Dann sondert sie aus dem After ein Flüssigkeitströpfchen ab, das über den Kopf abfließt und schließlich den ganzen Rücken gleichmäßig benetzt. Dadurch bleibt das Insekt längere Zeit feucht. Nun schiebt die Larve den Kopf in das Erdreich, bricht kleine Erdbrocken los und häuft sie vor sich auf. Dabei dreht sie sich, mit kleinen Pausen, im Kreis, bis sie von einem Ringwall umgeben ist. Bald werden jedoch die Wände nicht mehr gleichzeitig hochgezogen, sondern an einer Seite bevorzugt weiter gebaut. Hier wird die Wand zuerst senkrecht aufsteigend, dann überhängend, kuppelförmig und schließlich sich an der Gegenseite wieder senkend gefertigt, in dem die losgebrochenen Krumen angeklebt werden. Bevorzugt wird der Boden nun unter der sich senkenden Wand abgegraben und darüber angeklebt, so dass zwischen der nach unten wachsenden Wand und dem seitlich anstehenden Boden eine Spalte frei bleibt. Dies wird so fortgeführt, dass die entstehende Höhle Kugelform annimmt, und das abgegrabene Material wird zum Verkleinern und Verschließen der Höhlenöffnung verwendet. Nach ein bis mehrwöchiger Ruhe erfolgt die Häutung zur Puppe. Die Dauer des Puppenstadiums hängt hauptsächlich von der Temperatur und außerdem von der Feuchtigkeit ab. Bei 18 °C schlüpft die Imago etwa nach zwei Wochen. Bei höheren Temperaturen verkürzt sich diese Zeit kaum, bei niedrigeren Temperaturen dagegen erhöht sie sich beträchtlich, bei durchschnittlich 11 °C liegt sie bei etwa sechs Wochen. Die Jungkäfer verbleiben über die Aushärtung hinaus in der Puppenwiege, sie erscheinen mit Ausnahmen erst im Herbst.[11]
Verbreitung
Agabus bipustulatus ist eine paläarktische Art, sie ist in Europa, Nordafrika, im Nahen Osten und östlich bis Iran verbreitet. In Europa ist die Art lediglich aus einigen kleinen Ländern nicht gemeldet.[1]
Literatur
- Heinz Freude, Karl Wilhelm Harde, Gustav Adolf Lohse: Die Käfer Mitteleuropas. Band 3. Adephaga 2 - Staphylinoidea 1. Goecke&Evers, Krefeld 1971, ISBN 3-87263-015-6, S. 63.
Einzelnachweise
- Systematik und Verbreitung von Agabus bipustulatus bei Fauna Europaea.
- Marcus K. Drotz, Anssi Saura, Anders N. Nielssen: The species delimitation problem applied to the Agabus bipustulatus complex (Coleoptera, Dytiscidae) in north Scandinavia. In: Biological Journal of the Linnean Society. Band 73, Nr. 1, 2001, ISSN 0024-4066, S. 11–22, doi:10.1111/j.1095-8312.2001.tb01343.x (researchgate.net [PDF]).
- Konrad Dettner: Chemotaxonomy of water beetles based on their pygidial gland constituents. In: Biochemical Systematics and Ecology. Band 7, Nr. 2, 1979, S. 129–140
- Carolus Linnaeus: Systema Naturae…. 1. Band, Teil 2, 12. Ausgabe, Stockholm 1767, S. 667, Nr. 17 (biodiversitylibrary.org).
- Otto Frederik Müller: Fauna Insectorum Fridrichsdalina…. Kopenhagen und Leipzig (Hafnia Lipsia) 1764, S. 44:20 Nr. 194 (gdz.sub.uni-goettingen.de).
- Sigmund Schenkling: Erklärung der wissenschaftlichen Käfernamen (Art).
- Sigmund Schenkling: Erklärung der wissenschaftlichen Käfernamen (Gattung).
- Frederik Meinert: Vandkalvelarverne (Larvae Dytiscidarum). Kopenhagen 1901 in Det kongelige Danske Videnskabernes Selskabs Skrifter Serie 6, Nr. 9, Naturvidenskabelig og mathematisk Afdeling S. 372 Larve Agabus bipustulatus Zeichnungen zur Larve.
- Foto der Larve.
- Henri P. I. Bertrand: Larves et Nymphes des Coleoptères aquatiques du Globe. Imprimerie Paillard, Paris 1972.
- Hans Blunck: Kleine Beiträge zur Kenntnis des Geschlechtslebens und der Metamorphose der Dytisciden 3. Teil Agabus bipustulatus. In: Entomologische Blätter. Jg. 17, 1921, S. 184–194 (biodiversitylibrary.org).
- Foto Puppe.
- Adolf Horion: Käferkunde für Naturfreunde. Vittorio Klostermann, Frankfurt am Main 1949 S. 32, 33.
- A. Nilson, M. Holmen: The aquatic adephaga of Fennoscandia and Denmark II Dytiscidae. In: Fauna Entomologica Scandinavia. 1995.
- Donald A. Yee (Hrsg.): Ecology, Systematics and Natural History of Predaceous Diving Beetles (Coleoptera, Dytiscidae). Springer, Dordrecht 2014, ISBN 978-94-017-9108-3, ISBN 978-94-017-9109-0 (eBook) doi:10.1007/978-94-017-9109-0 S. 323 in der Google-Buchsuche.
- Dorothy J. Jackson: Observations on the Capacity for Flight of Water Beetles. In: Proceedings of the Royal Entomological Society of London Series A, General Entomology. Band 27, Nr. 7–9, 2009, ISSN 0375-0418, S. 57–70, doi:10.1111/j.1365-3032.1952.tb00155.x.
- Hans Blunck: Kleine Beiträge zur Kenntnis des Geschlechtslebens und der Metamorphose der Dytisciden 1. Teil. In: Zoologischer Anzeiger. Band 41, 1913, S. 541 (biodiversitylibrary.org Paarung von Agabus undulatus, nach Blunck identisch mit dem Paarungsverhalten von Agabus bipustulatus).