Florentiner Prachtkäfer
Der Zweibindige Eichenprachtkäfer oder Florentiner Prachtkäfer (Coraebus florentinus oder Coroebus fasciatus) ist ein Käfer aus der Familie der Prachtkäfer (Buprestidae).[1] Das in verschiedenen Grüntönen metallisch schillernde Tier kommt als wärmeliebende Art hauptsächlich in Südeuropa vor. Auf Grund seiner Lebensweise bekommt man die Art jedoch nur selten zu Gesicht. Die Larvengänge haben einen ungewöhnlichen Verlauf, der kurz vor der Verpuppung zum Absterben des befallenen Astes führt.
| Florentiner Prachtkäfer | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Florentiner Prachtkäfer (Coraebus florentinus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Coraebus florentinus | ||||||||||||
| (Herbst, 1801) |
Die Art ist wie die meisten Prachtkäfer gemäß der Bundesartenschutzverordnung gesetzlich besonders geschützt.[2] In der Roten Liste gefährdeter Arten Deutschlands wird die Art unter der Kategorie 1 (vom Aussterben bedroht) geführt.[3]
Bemerkungen zum Namen, Synonymen und Systematik
Die Art ist traditionell nach der Beschreibung von Herbst 1801 als Buprestis florentina benannt. Die Beschreibung enthält die Bemerkung Das Vaterland ist Florenz.[4] Dadurch erklärt sich der Artname florentīna (bei Florenz, Floréntia, vorkommend).[5] Das Verbreitungsgebiet ist wesentlich größer. Es gibt ältere Beschreibungen dieser Art, deren Artnamen aber inzwischen für andere Arten benutzt werden. Olivier beschrieb die Art 1790 als Buprestis bifasciata, ein Jahr zuvor wurde sie von Villers als Buprestis fasciata beschrieben. Im neuesten Katalog der paläarktischen Käfer heißt die Art wieder Coraebus fasciatus (Villers 1789). Die Beschreibung des Käfers durch Villers enthält das Merkmal ...elytris tribus fasciis viridi-violaceis… (lat. mit drei grün-violetten Binden auf den Flügeldecken).[6] Damit erklärt sich das Art-Epitheton fasciatus (lat. gebändert)[5]
Als Art-Epitheton existieren folgende Synonyme
- florentinus Herbst 1801
- fasciatus Villers 1789
- bifasciatus Olivier 1790
- trifasciatus Regimbeau 1876
- aethiops Obenberger 1924
- mequignoni Obenberger 1934
- obscuricollis Pic 1894
- obscuricolor Pic 1893
- obscurior Pic 1933
- semiviolaceus Pic 1894
Es sind keine Unterarten oder lokale Rassen bekannt. Viele der unter den Synonymen aufgeführten Namen stehen für vereinzelt auftretende Farbvarianten, beispielsweise Flügelbehaarung golden (mequignoni), Flügeldecken blau (nitraensis) oder violett (pici).[1]
Die frühen Beschreibungen ordnen die Art alle der Gattung Buprestis zu. Bei der Aufspaltung der Gattung Buprestis durch Eschscholtz 1829[7] verbleibt die Art in der Restgattung Buprestis. Die Gattung Caraebus wird erst 1836 von Laporte&Gory aufgestellt.[1] Der Gattungsname Corāēbus ist von altgr. Κόροιβος Kóroibos, einem Sieger in Olympischen Spielen, abgeleitet und müsste nach Schenkling richtig Coroebus lauten.[8]
Als Gattungsname der Art findet man neben
- Coraebus Laporte & Gory 1836
- Coroebus Cast. beispielsweise noch im Standardwerk Freude-Harde-Lohse und im Internet fast doppelt so häufig wie Coraebus. Außerdem ist die Gattung synonym zu
- Coaegrilus Fairmaire 1889 und
- Negreia Cobus 1962[1]
Die Gattung Coraebus in Europa mit fünf Arten vertreten,[9] weltweit gibt es 225 Arten.[10]
 |
 |
| Abb. 1: Unterseite | Abb. 4: Seitenansicht |
 |
 |
| Abb. 2: Vorderansicht | |
 | |
| Abb. 3: Krallenglied | Abb. 5:Spitze der Flügeldecke |
Merkmale
Merkmale des Käfers
Der Körper des Florentiner Prachtkäfers ist länglich oval und bei 13 bis 16 Millimetern Länge knapp dreimal so lang wie breit. Die Körperoberseite ist metallisch grün mit kupfrigen Schattierungen, die Unterseite metallisch grün mit einer Tendenz zu blaugrün. Die Flügeldecken weisen in der hinteren Hälfte drei wellen- bis zickzackförmige dunkle Querbinden auf, die von drei davor liegenden helleren und behaarten Querbinden getrennt sind. Die vorderste behaarte Querbinde ist nur angedeutet oder kann ganz fehlen (Abb. 5). Deswegen führt der Käfer den deutschen Namen Zweibindiger Eichenprachtkäfer, in Abgrenzung zum ebenfalls an Eichen lebenden Coraebus undatus, der mehrere behaarte Binden aufweist. Die Behaarung ist auch auf der Stirn ausgeprägt (Abb. 2 in höherer Auflösung), ebenso auf der Körperunterseite (Abb. 6 in höherer Auflösung). Sonst ist der Käfer sehr spärlich, kurz und gelblich, auf der Scheibe des Halsschildes verschwindend behaart. Antennen und Beine sind kaum behaart, nur auf dem Schenkelringen (Trochanteren), besonders des zweiten und dritten Beinpaars, stehen die Haare dicht (Abb. 6 in höherer Auflösung). Der Körper ist sowohl der Länge als auch der Breite nach nur wenig gewölbt, seine höchste Stelle liegt nur wenig hinter der Basis der Flügeldecken (Abb. 4).
Der Kopf ist von oben betrachtet viel breiter als lang und in den Halsschild zurückgezogen. Die großen Augen bedecken weitgehend die Seiten des Kopfes, ihr Hinterrand verläuft in kleinem Abstand parallel zum Vorderrand des Halsschildes (Abb. 2, Abb. 4). Die Mundwerkzeuge zeigen nach unten. Die Oberlippe ist rechteckig. Die Oberkiefer sind kräftig, gebogen, zugespitzt, auf der inneren Seite ausgeschnitten mit einem stumpfen Zahn versehen. Das erste Kiefertasterglied ist sehr klein, das zweite lang, das dritte wieder kleiner und dreieckig und das vierte dicker und eiförmig. Das Lippentasterendglied ist groß und keulenförmig. Über den Mundwerkzeugen sind die elfgliedrigen Fühler eingelenkt, die ab dem vierten Glied nach innen erweitert (gesägt) sind (Abb. 2). Am Kopf ist keine Rinne erkennbar, in der die Fühler eingelegt werden können.
Der Halsschild ist viel breiter als lang, vorne kaum breiter als der Kopf, dann verbreitert er sich auf die Breite der Flügeldecken. Seine Basis ist seitlich der Mitte deutlich nach vorne ausgebuchtet (doppelt gebuchtet). Sein Seitenrand ist gerillt (Abb. 2 bei hoher Auflösung) und nicht wie bei den ähnlichen Arten der Gattung Agrilus doppelt. An der Basis ist der Halsschild ohne sichtbare Eindrücke, in den Hinterwinkeln ohne Kiel. Es ist punktiert und nicht gerunzelt.
Die Flügeldecken sind lang, größtenteils parallel und verjüngen sich gegen die Spitze gleichmäßig. Am Hinterende sind sie abgerundet. Sie sind unregelmäßig punktiert. Die Ränder sind an der Spitze fein gesägt (Abb. 5). Das Schildchen ist dreieckig, nach hinten stark zugespitzt und hat keinen Querkiel, wie die sonst ähnlichen Arten der Gattung Agrilus.
Die Hinterflügel sind nach dem Canthariden-typus geadert. Costa und Subcosta sind verwachsen. Von den drei Radialadern ist die erste nur an der Basis von den andren Adern getrennt, außen verwächst sie mit Costa und Subcosta. Weiter finden sich zwei Cubital-, drei Anal- und zwei Jugaladern, die alle sehr schwach ausgebildet sind. Die Existenz einer zweiten Jugalader unterscheidet C. florentinus von der nahe verwandten Art C. undatus.
Auf der Körperunterseite werden für die Artbestimmung wichtige Merkmale sichtbar (Abb. 6). Die Vorderbrust ist zum Kopf hin ohne eine aufgeworfene Erweiterung (Kinnbinde). Dies grenzt die Gattung von den beiden anderen mitteleuropäischen Gattungen der Tribus Coraebini ab. Die Vorderhüfthöhlen, in die die Vorderhüften eingelenkt sind, sind nach hinten offen. Die Vorderhüften (Abb. 6, rechts orange) sind kugelig und durch einen Fortsatz der Vorderbrust (Prosternalfortsatz, Abb. 6, rechts grün) weit voneinander getrennt. Dieser Fortsatz reicht bis in eine Aussparung in der Hinterbrust (Abb. 6, rechts gelb). Die an die Hinterbrust seitlich anschließende Platte des Außenskeletts (Episternum, Abb. 6, rechts rot) ist nicht durch die Seiten der Flügeldecken verdeckt und von unten deutlich sichtbar. Die Hinterhüften (Abb. 6, rechts blau) liegen der Hinterbrust hinten breit an. Sie sind nach innen nicht erweitert und nach außen verbreitert und drängen die Episternen der Hinterbrust zurück. Nach hinten sind die Hinterhüften zur teilweisen Aufnahme der Hinterschenkel ausgehöhlt (Schenkeldecken).
Alle Beine sind verhältnismäßig zierlich, da sie für die Fortbewegung von untergeordneter Bedeutung sind. Die Tarsen sind fünfgliedrig, die ersten vier Glieder unten gelappt. Das erste Tarsenglied ist länger als die folgenden, aber nicht so lang wie das zweite und dritte zusammen. Die Krallen sind geteilt (Abb. 3, Lappen des 4. Tarsenglieds braun hinter den Krallen sichtbar).
Die Unterschiede zwischen Männchen und Weibchen (Geschlechtsdimorphismus) sind nicht auffallend. Bei den Männchen sind die Fühler etwas länger als bei den Weibchen, bei denen sie den Hinterrand des Halsschilds nicht erreichen. Bei den Männchen sind außerdem die schwarzen Bänder der Flügeldecken breiter, das letzte Abdominalsternit weniger abgerundet, und der gesamte Körper untersetzter als bei den Weibchen.
 |
| Abb. 6: Brustabschnitt von Coraebus florentinus von unten, rechte Seite teilweise koleriert grün: Prosternalfortsatz orange/grau/blau: Vor-/Mittel-/Hinterhüfte gelb: Mittelbrust, rot:Episternum der Hinterbrust |
Merkmale der Larve
Da Käferlarven wesentlich weniger zur Artbestimmung relevante Merkmale aufweisen als adulte Käfer, ist es notwendig, die wenigen sklerotisierten und deswegen formstabilen Teile genau zu beschreiben. Dies sind häufig nur die Mundwerkzeuge. Beschrieben wird das letzte Larvenstadium.
Die Larve ist stark der im Holz bohrenden Lebensweise angepasst. Sie ist abgeplattet zylindrisch, blind, fußlos und außer an den Körperenden weichhäutig und ohne Farbpigmente. Das letzte Hinterleibssegment (Analsegment) trägt zwei stark sklerotisierte kurze Anhänge, die nebeneinander sitzen und nach hinten zeigen. Sie bilden gemeinsam eine Zange, deren Hälften auf der Innenseite im letzten Larvenstadium je fünf Zähne aufweisen. In früheren Stadien sind diese Zähne zu Beginn jedes Larvenstadiums gut ausgeprägt, nutzen sich aber bis zur nächsten Häutung ab.
Die Vorderbrust ist breiter als Mittel- und Hinterbrust, aber nicht wie bei vielen Prachtkäferlarven deutlich breiter als die Segmente des Hinterleibs. Die Vorderbrust ist 1,4-mal so breit wie lang und stark abgerundet. Auf Rücken- und Bauchseite ist die Haut zu einer Platte verdickt. Die Rückenplatte hat zwei parallele Längsrillen, die fast den Hinterrand der Platte erreichen und deren braune Farbe am Vorderende ausbleicht. Die Bauchplatte der Vorderbrust weist nur eine Rille auf, die farblos und nach hinten geöffnet ist. Die Mittelbrust ist deutlich schmäler als die Vorderbrust und zwei- bis dreimal so breit wie lang. Sie ist das einzige Brustsegment mit Atemöffnungen (Stigmen). Auf der Mitte der Seiten dieses Segmentes befindet sich leicht auf die Bauchseite gerückt je ein Stigma. Die Hinterbrust ist das schmälste der drei Brustsegmente, aber größer als die Mittelbrust. Sie ist weniger als doppelt so breit wie lang und ohne morphologische Besonderheiten.
Die ersten sieben Hinterleibsglieder sind recht groß, das erste kleiner als das erste Brustsegment aber größer als das zweite, die folgenden Hinterleibssegmente werden zunehmend größer. In der Aufsicht werden sie von vorne nach hinten von rundlich über rechteckig zunehmend trapezförmig. Das achte Hinterleibssegment hat etwa die Form der Hinterbrust, das neunte verbreitert sich nach hinten und besitzt dort eine Falte, in die das Analsegment teilweise eingeschoben werden kann. Das Analsegment verengt sich zu der Basis der Zange hin.
Die ersten acht Hinterleibssegmente tragen je ein Paar Stigmen in einer ovalen Vertiefung in Längsrichtung auf jeder Seite des Rückens. Solche Vertiefungen finden sich auch auf der Bauchseite, jedoch ohne Stigmen. Sie sind körnig und etwas dunkler gefärbt als der Rest des Segments.
Die Oberkiefer, der Bereich um den Mund (Peristom) und die Zange am Körperende sind dunkelbraun, die Anhänge der Mundwerkzeuge, die Atemöffnungen und die Region an der Basis der Zange sind hellbraun, der übrige Körper weiß bis gelblich. Der Körper ist spärlich behaart. Diese Behaarung ist in den letzten zwei Dritteln Analsegments dichter und länger. Die Fühler sind dreigliedrig und zeigen nach vorne unten. Das Basalglied ist am größten, rundlich und weist eine Reihe kleiner Härchen am Vorderende über der Basis des zweiten Fühlerglieds auf. Das zweite Fühlerglied ist viel kleiner als das erste, kurz und zylindrisch. An seiner Außenseite befindet sich neben der Einlenkung des dritten Fühlerglieds eine mächtige, leicht nach oben gekrümmte Einzelborste, daneben zwei stark verästelte kleine Sinnesborsten. Das dritte Fühlerglied ist nochmals wesentlich kleiner und zahnförmig.
Die Mundwerkzeuge sind nach vorne gerichtet, die oberhalb des Mundes liegende Region des Körpers wird Epistom genannt, die unterhalb befindliche Hypostom, die seitlich befindliche Pleurostom. Das Epistom ist stark sklerotisiert, gekrümmt und fünf bis sechsmal so breit wie lang. Im Mittenbereich findet man zwei punktförmige Vertiefungen. Davor entspringt eine breite Chitinplatte (Kopfschild, Clypeus) an die nach vorne die Oberlippe anschließt. Vor dem seitlichen Abschluss ist das Epistomum vorne beulig verdickt. Dort sind die Oberkiefer eingelenkt. Der Hinterrand ist im Mittelbereich leicht gewellt, seitlich ist er bei den Einlenkungen der Fühler eingeschnitten. Der Kopfschild ist häutig und halbtransparent, rechteckig mit abgerundeten Ecken bis halbkreisförmig und 3,5- bis viermal breiter als lang. Die Oberlippe ist ebenfalls membranös, mit abgerundeten Rändern und 2,5- bis 4-mal so breit wie lang. Sie besitzt an den Seiten je eine Borste, die den Vorderrand überragt und oberseits seitlich je eine kürzere Borste.
Das Hypostoma besteht aus zwei Teilen, die mit der Submentum hinter dem Kinn (Mentum) in einer Linie liegen. An der Basis der Seite jedes der Teile entspringt in einer Vertiefung eine kleine Borste.
Die seitliche Begrenzung des Mundes (Epistom) ist ein dreieckiger Chitinplatte mit stark erweitertem Zentralbereich. Sie ist mit dem Hypostom verwachsen. In ihrem Zentrum befindet sich eine wenig chitinisierte erhabener Bereich in Form einer Ellipse, in deren Nähe eine kleine Borste entspringt.
Der über dem Schlund liegende Bereich (Epipharynx) trägt eine Reihe von Borsten. Je vier Borsten mit stumpfer Spitze sitzen außen am Vorderrand, seitlich dahinter je zwei weitere zugespitzte, die vordere größer als die stumpfen, die hintere kleiner. Außerdem besitzt der Epipharynx zwei nach innen zeigende Borsten seitlich innen vorne. Der Vorderrand des Epipharynx ist stark behaart und leicht nach innen eingebuchtet. Die Seitenränder sind parallel zueinander. Die Schlundplatten sind stark sklerotisiert und weit nach hinten verlängert. Der dicht behaarte Zentralbereich ist das Geschmacksorgan.
Der unter dem Schlund liegende Bereich (Hypopharynx) ist membranös und stark behaart. In seiner Mitte liegt das Geschmacksorgan des Unterschlunds. Es ist durch eine Behaarung in Form eines breiten nach unten offenen V charakterisiert.
Die Oberkiefer sind kurz und kräftig, mit zwei Zähnen an der Spitze, wobei der oben liegende kleiner ist. Eine Gruppe von Sinnerhaaren bildet ein sensorisches Feld, das sich seitlich innen an der Basis befindet. Der Gelenkkopf ist markant und abgerundet, über ihm auf der Oberseite befindet sich eine kleine Grube, in der eine Borste entspringt.
Das Kinn zeichnet sich durch leichte Eindrücke aus. Seitlich ist es teilweise mit den Unterkiefern verwachsen. Das Basalglied des Unterkiefers (Cardo) ist häutig und durchscheinend. Es trägt zwei senkrecht abstehende Borsten, von denen die innere etwas kleiner ist. Das darauffolgende Glied (Stamm, Stipes) ist unten abgeplattet, oben rundlich und trägt am Vorderende eine dicke, lange Borste, die den Unterkiefertaster (Maxillarpalpus) überragt. Dieser ist zweigliedrig, das erste rundliche Glied trägt auf dem äußeren Vorderrand einen Saum von Haaren, auf dem seitlichen Außenrand auf halber Höhe befindet sich eine kräftige Borste. Das zweite Segment des Maxillarpalpus ist konisch und vorne gekörnt, auf der Innenseite gröber. Die membranöse Innenlade trägt acht Borsten, drei spitze und fünf kürzere stumpfe, die den seitlichen Innenrand herunterlaufen. Die Maxille erscheint am Innenrand mit langen Haaren dicht gesäumt.
Die Lippe ist membranös und am Vorderrand stark behaart. Seitlich trägt sie zwei lange Borsten, die den Vorderrand überragen. Seitlich der Basis dieser Haare finden sich unregelmäßige Strukturen, die man als Reste von Lippentastern interpretieren kann.
Die Unterschiede zwischen den Larvalstadien sind nicht so ausgeprägt wie beispielsweise bei Coraebus undatus, sondern beziehen sich ausschließlich auf die durchschnittlichen biometrischen Größen und auf die Anzahl der Zähne an der Zange des Analsegments. Im ersten Larvenstadium weisen die Zangen des Analsegments nur zwei Zähne auf. Im zweiten Larvalstadium sind die beiden Zähne stärker ausgeprägt und ein dritter andeutungsweise erkennbar. Im dritten Larvalstadium zeigen die Zangen vier Zähne, wobei der vierte ziemlich klein ist. Im vierten Larvalstadium zeigen die Zangen bereits fünf Zähne, die jedoch erst im letzten Larvalstadium gleich stark ausgebildet sind. An biometrischen Daten ist am markantesten die durchschnittliche Länge der Larven. Sie steigt von 9,7 mm beim ersten Larvalstadium über 16,75, 21,33 30,00 bis auch 36,78 mm im letzten Larvenstadium. Die anderen Körpermaße steigen ebenfalls, aber nicht analog. Dies zeigt deutlich das Verhältnis der Breite der Vorderbrust zur Breite des Analsegmentes. Es verringert sich von 1,48 beim ersten Larvenstadium über 1,36 beim zweiten und dritten auf 1,28 beim vierten und fünften Stadium. Das schmalere Analsegment nähert sich in seiner Breite demnach zunehmend der Breite der Vorderbrust an.
Merkmale der Puppe
Die Puppe ist weiß, weich und nackt. Die Form des fertigen Käfers ist bereits gut erkennbar. Von den drei Brustsegmenten ist das mittlere das schwächste. Die Oberseite der Vorderbrust ist gerunzelt. Der Prosternalfortsatz ist deutlich ausgebildet. Das Schildchen schließt an die Mittelbrust an und trennt diese von der Hinterbrust. Am Hinterleib kann man sieben Rückplatten (Tergite) und fünf Bauchplatten (Sternite) unterscheiden. Alle Tergite außer dem letzten besitzen im vorderen Außenwinkel je eine Atemöffnung. Die beiden ersten Abdominaltergite sind miteinander verwachsen und zeigen eine deutliche gerade verlaufende Nahtlinie. Am Hinterleibsende sind zwei Tergite und drei Sternite ineinander geschoben. Sie werden das zukünftige Fortpflanzungsorgan bilden.
Die Fühler sind auf der Bauchseite schräg nach hinten außen gestreckt. Bei den Weibchen erreichen sie das Gelenk zwischen Schenkel und Schiene des ersten Beinpaars nicht, bei den Männchen gerade noch. Die Vorderflügelanlagen sind stärker ausgeprägt als die Anlagen der Hinterflügel und bedecken letztere fast völlig. Die Beine liegen dem Körper an, sind aber außer an der Basis nicht mit ihm verwachsen, sondern frei.
Merkmale des Eies
Das Ei hat ungefähr die Form eines Ellipsoides, wobei aber die Seite, an der es am Substrat klebt, deutlich abgeflacht ist. Es ist durchschnittlich zwei Millimeter lang und an der breitesten Stelle 1,7 mm breit. Die Oberfläche ist ziemlich glatt, die Zonen an denen es das Substrat oder gegebenenfalls andere Eier berührt sind sehr glatt. Bei der Ablage ist es weiß, nimmt aber bald danach bräunliche Töne an.
Biologie
Lebenszyklus
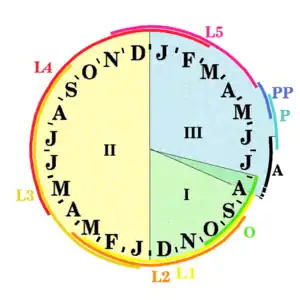 |
| Abb. 7: Lebenszyklus einer Generation Zeitintervalle, in denen die Stadien auftreten I, II, III erstes, zweites, drittes Kalenderjahr J, F, M, ….. Januar, Februar, März….. grün O: Ei, gelb L1: erstes Larvalstadium, braun L2: zweites und ocker L3: drittes Larvalstadium, rot L4: viertes und lila L5: fünftes Larvalstadium, blau PP: Vorpuppe, türkis P: Puppe, schwarz A: Adult |
Als Dauer des Lebenszyklus werden zwei bis drei Jahre angegeben. Die hier gegebenen zeitlichen Angaben gelten für die Region Gargano in Mittelitalien.
Die Käfer verlassen die Puppenwiege in einem zeitlich kurzen Rahmen in der zweiten Julihälfte. Sie sind hauptsächlich in den wärmsten Stunden des Tages und in der prallen Sonne aktiv. Sie halten sich dabei vorzugsweise im Wipfelbereich der Brutbäume auf. Dort benagen sie unregelmäßig und in unbedeutendem Umfang die Blätter. Bereits bei geringen Störungen ziehen sie im Regelfall die Beine eng an den Körper und kullern auf den Boden, wo sie reglos liegen bleiben und schwer auffindbar sind, oder sie fliegen mit erstaunlich hoher Geschwindigkeit davon. Deswegen gibt es keine genaueren Angaben über Verhaltensweisen im Zusammenhang mit der Paarung.
Im Gefangenschaft geschlüpfte Männchen leben durchschnittlich zehn bis elf Tage, Weibchen einen Tag länger. Es ist deswegen anzunehmen, dass Kopulation und Eiablage rasch erfolgen. Gegen Ende August sind die Käfer nahezu verschwunden.
Die Eiablage erfolgt ab Ende Juli mit dem Maximum in den ersten zehn Tagen des Augusts. In später abgelegten Eiern erfolgt die Embryonalentwicklung langsamer. Mitte September sind die meisten Larven aus den Eiern geschlüpft. Man kann aber noch bis Ende Oktober Eier finden, aus denen die Larven noch nicht geschlüpft sind. (Abb. 7, grün, O)
In früh abgelegten Eiern benötigt die Embryonalentwicklung nur etwa zwei Wochen. Die ersten Larven schlüpfen also bereits Mitte August. Die sehr spät geschlüpften Larven aus später gelegten Eiern brauchen für ihre Entwicklung am längsten, sodass man in den Brutbäumen bis Mitte März des folgenden Jahres Tiere der Generation finden kann, die sich im ersten Larvenstadium befinden. (Abb. 7, gelb, L1)
Die Häutungen zwischen den einzelnen Larvenstadien streuen weiter. Tiere der Generation, die sich im zweiten Larvenstadium befinden, treten zwischen dem ersten Drittel des Septembers bis in den späten März des kommenden Jahres auf (Abb. 7, orange, L2). Tiere der gleichen Generation, die sich im dritten Larvenstadium, also zwischen der zweiten und dritten Häutung befinden, findet man vom ersten Drittel des Januar bis zum ersten Drittel des Oktober des gleichen Jahres. (Abb. 7, ocker, L3) So kann man etwa im Februar des zweiten Jahres Tiere im ersten, zweiten und dritten Larvalstadium vorfinden, die zur gleichen Generation gehören. Das vierte Larvalstadium erstreckt sich vom letzten Drittel des Aprils im Folgejahr der Eiablage bis zum Ende des darauffolgenden Februars. (Abb. 7, hellrot, L4). Das fünfte und letzte Larvenstadium findet man zwischen dem letzten Drittel des Novembers und Ende April. (Abb. 7, lila, L5).
 |
Abb. 8: Teilan- sicht der Kro- ne einer Steineiche, im Zentrum und links je ein durch Befall von Coraebus florentinus abgestorbe- ner Ast mit braunen Blättern |
 | |
| Abb. 9: Toter Ast mit "Strangulationsgang", Rinde entfernt. 1: Absteigender Abschnitt, 2,3: horizontaler Abschnitt, 4: aufsteigender Abschnitt, welcher 5: nach innen ab- knickt und dann in die Puppenwiege mündet. | |
Für die Eiablage sucht das Weibchen der Sonne ausgesetzte Äste, vorzugsweise auf der Süd- bis Südwestseite der Brutbäume auf (Abb. 8). Dort umkreist es die jungen Eicheln, die zu dieser Jahreszeit etwa erbsengroß und noch ganz vom Fruchtbecher umgeben sind. Nach einer Inspektion, die mehrere Minuten lang dauern kann, legt das Weibchen an einer geschützten Stelle der Frucht lediglich ein Ei ab. Dann entfernt sie sich auf ein nahes Blatt und beginnt mit der Nahrungsaufnahme. Gewöhnlich legt das Weibchen nur ein Ei pro Eichel, man kann aber auch bis zu vier Eier an einer Eichel finden. In Ausnahmefällen werden Eier an der Spitze der Endknospen kleinerer Äste abgelegt. Gegen Ende des Embryonalstadiums befindet sich die Larve in Form eines Ringes zusammengekrümmt im Ei, den Kopf in Richtung des Teils des Eies, das am Substrat angeheftet ist. So dringt die Larve beim Schlüpfen aus dem Ei direkt in den Fruchtbecher der Eichel ein. Davor verzehrt sie das restliche Dottermaterial, das im Innern der Eischale eingeschlossen ist und mit der Zange am Analsegment sorgsam zusammen geschoben wurde. Dann nagt sie sich durch Fruchtbecher und Pericard zum Samen. Anschließend frisst sie sich durch den Fruchtstiel. Wenn sich am Stiel eine weitere Eichel befindet, durchnagt sie möglicherweise auch diese. Danach dringt sie in den Ast ein. Wurde das Ei an die Spitze einer Blattknospe gelegt, so durchnagt sie diese und füllt sie mit ihren Exkrementen, während sie einen in den Zweig absteigenden Gang bohrt.
Erst Mitte September hat die Mehrzahl der Primärlarven die Eier verlassen. Nach der ersten Häutung fressen sich die Larven weiter vorwärts und hinterlassen dabei Gänge, die stets in Richtung zum Stamm absteigend sind. Die Gänge verlaufen jedoch nicht gradlinig, sondern mal tiefer ins Holz eindringend, mal an der Peripherie des Zweigs. Dabei dringen die Larven in zunehmend dickere Zweige vor und entfernen sich 20 bis 50 cm von der Stelle, an der das Ei abgelegt wurde. Danach vollzieht sich ein plötzlicher Wechsel im Verlauf des Ganges. Die Larven bohren sich senkrecht zur Astachse in den äußeren Bereich des Astes und von dort nach oben. Nach einer kurzen Strecke wird erneut die Richtung gewechselt und die Gänge verlaufen wieder abwärts. Während dieser Zeit vollzieht die Larve zwei Häutungen. Larven aus früh abgelegten Eiern beginnen die Spiralgänge in der zweiten Märzhälfte und vollenden sie etwa einen Monat später. Die dritte Häutung passiert bei der Mehrzahl der Larven im ersten Drittel des Mai, neun Monate nach dem Höhepunkt der Eiablage. Bei späten Larven kann sie sich jedoch bis Mitte Oktober hinausschieben. Nach dieser Häutung gräbt sich die Larve wieder in die äußeren Schichten des Zweigs und steigt dort wieder ab. So dringt sie in immer dickere Äste ein und kann bei jüngeren Pflanzen bis in den Stamm vordringen. Sie kann sich dabei bis zu einem Meter von der Stelle der Eiablage entfernen. Nun beobachtet man die letzte Richtungsänderung. Die Larve, die sich jetzt im fünften und letzten Stadium befindet, hat ihre größte Länge erreicht. In insgesamt eineinhalb Windungen frisst sie flach absteigend in den äußeren Astschichten (Abb. 9, 1). Der Fraßgang setzt sich annähernd ringförmig senkrecht zur Astachse (Abb. 9, 2,3) fort. Der nun wieder ansteigende Gang (Abb. 9, 4) kreuzt sich mit dem absteigenden Abschnitt. Auf diese Weise wird die Gefäßschicht vollständig unterbrochen und das Absterben des Asts durch „Strangulation“ eingeleitet. Dann biegt der Gang ins Zentrum des Astes ab. Der letzte Gangabschnitt wird als Puppenwiege angelegt. Sie ist erweitert, im Querschnitt rundlich, im Längsschnitt andeutungsweise halbmondförmig (semilunar). Er führt von der Längsachse des Astes nach oben und krümmt sich dabei zur Rinde. Man findet jedoch auch häufig nach unten verlaufende Puppenwiegen (Abb. 10, C). Das Ausschlupfloch wird genagt und mit Bohrmehl verstopft. Anschließend vollzieht sich die Metamorphose zum Käfer in der Puppenwiege.
 |
| Abb. 10: A: Ausschlupfloch vor dem Schlüpfen, mit Bohrmehl verstopft B: Ausschlupfloch nach dem Schlüpfen (Puppenwiege nach unten) C: Ast in der Ebene der Puppenwiege gespalten (Puppenwiege nach unten) |
Die ersten Larven, die mit dem Anlegen des „Strangulationsganges“ beginnen, findet man im ersten Drittel des März, das Maximum liegt in der zweiten Märzhälfte und der ersten Aprilhälfte, also etwa 20 Monate nach der Eiablage. Mitte Mai findet man fast nur noch Vorpuppen und bereits einige Puppen. Vorpuppen findet man in der Puppenwiege von Ende April bis Ende Mai (Abb. 7, blau, PP), Puppen vom zweiten Drittel des Mai bis Ende Juni (Abb. 7, türkis, P).
Die Anlage der Puppenwiege erfolgt von Mitte März an, in der Regel Ende März und in der ersten Aprilhälfte, also 20 Monate nach der Eiablage. Dort entwickelt sich die Larve zur Vorpuppe und häutet sich bald darauf zur Puppe. Ab der zweiten Maihälfte finden sich keine Larven mehr, nur noch Vorpuppen und wenige Puppen. Die Puppe ähnelt bereits dem fertigen Käfer (Pupa libera), die Beine, Flügel und Mundwerkzeuge sind deutlich erkennbar. Die Pigmentierung beginnt an den Augen, es folgen die Rückenplatten des Hinterleibs (Tergite), der Kopf, der Brustabschnitt, die Bauchplatten des Hinterleibs und zuletzt die Körperanhänge. Nach und nach nimmt die Puppe die Färbung der Imago an. Nach etwa zwei Wochen ist die Puppe fertig entwickelt und weitgehend ausgefärbt. Die Puppenhülle bricht entlang einer dorsalen Linie auf und das Adult schlüpft. Einige Stunden später ist der Käfer ausgefärbt.
Für die Entwicklung braucht die Puppe knappe drei Wochen, es kann also ab Mitte Juni mit Käfern gerechnet werden. Die Mehrzahl der Puppen schlüpft jedoch Ende Juni, Anfang Juli. Die Käfer verbleiben dann in der Puppenwiege und verlassen diese meist in Gruppen Ende Juli. In der ersten Julihälfte weisen alle befallenen Äste die Ausschlupflöcher auf. Sie zeigen eine charakteristische Form, die zwischen Halbkreis und stumpfwinklig gleichschenkligem Dreieck liegt. Der Scheitel des Dreiecks liegt auf der Seite, die der Puppenwiege zugewandt ist (Abb. 8A, 8B). Bereits Anfang August sind die Puppenwiegen weitgehend leer oder von Parasitoiden bewohnt. Mit der Eiablage verschwinden die Käfer wieder (Abb. 7, schwarz, A).
Wirtspflanzen
Wirtspflanzen sind außer den wirtschaftlich interessanten Eichen Steineiche (Quercus ilex) und Korkeiche (Quercus suber) die Stieleiche (Quercus robur), Flaumeiche (Quercus pubescens), Zerreiche (Quercus cerris), Kermeseiche (Quercus coccifera) und Traubeneiche (Quercus petraea) sowie vermutlich alle weiteren Eichenarten. Außerdem wurde die Larve in der Esskastanie (Castanea sativa) gefunden.
Natürliche Feinde
Die natürlichen Feinde des Florentiner Prachtkäfers sind noch wenig erforscht. Sie finden sich hauptsächlich unter den Pilzen und Endoparasiten. Diese fordern hauptsächlich von der ersten Entwicklungsstadien des Insekts ihren Tribut. Unter den Endoparasiten bilden die Hautflügler eine wichtige Gruppe. Hierzu gehört der erste bekannt gewordene Endoparasit von Coraebus florentinus, Cryptus maculipennis. Neben diesem schon 1902 von Perraudiere erkannten Endoparasiten werden Xylophrurus coroebi, Echtrus reluctator und Cerceris bupresticida genannt. Weiterhin werden die Brackwespen Spathius rabjabii und Bracon maculifer angeführt. Von letzterer ist jedoch nicht sicher, ob sie tatsächlich die Larven von Coraebus florentinus parasitiert. Am besten untersucht ist Cryptus maculipennis. Das Adult fliegt im März–April und legt seine Eier in das fünfte Larvalstadium von Coraebus florentinus. Die Larven entwickeln sich während sich der Käfer in der Puppenwiege befindet und ernähren sich von diesem.
 |
 |
 | |
| Abb. 11: Lebensraum des Florentiner Prachtkäfers: Eichenwälder | |
Schadwirkung und Schutz
Die Schäden, die von Coraebus florentinus verursacht werden, sind in der Regel gering. Die Fraßschäden der adulten Käfer an den Blättern sind unbedeutend. Die Äste, die durch den Larvenfraß zum Absterben gebracht werden haben einen Durchmesser von weniger als sechs Zentimeter. Der anfängliche Larvenfraß führt zum teilweisen Vergilben der Blätter, welches zwei bis drei Wochen nach dem Befall bemerkbar wird. Im April und Mai des Jahres der Verpuppung trocknen die befallenen Äste völlig aus, da die Fraßgänge die Wasserzufuhr unterbinden. Bei jungen Bäumen kann bei starkem Befall der Großteil der Baumkrone betroffen sein, bei älteren Bäumen kann ein Teil der Äste der Baumkrone absterben, die Blätter vergilben und fallen ab. In Folge reduziert sich der Zuwachs an Holz, die Produktion von Eicheln und speziell bei Korkeichen von Kork.
Die Wirtspflanze reagiert auf den Befall, die geschädigten Gewebe vernarben und in kleinem Umfang erholen sich befallene Äste und sterben nicht ab. Der Käfer befällt auch vorzugsweise bereits geschwächte Bäume. In naturnahen Baumbeständen besteht ein biologisches Gleichgewicht, der Käfer tritt selten auf und schädigt die Wirtspflanzen nicht wesentlich. Wenn jedoch durch die Bewirtschaftungsformen des Menschen die Wirtspflanzen besonderem Stress ausgesetzt sind, kann der Käfer als weiterer Stressfaktor vor allem in Zusammenarbeit mit weiteren Schädlingen zum Absterben der Wirtspflanzen führen.
Als wirksamstes Mittel gegen den Befall wird das Abreißen der absterbenden Äste empfohlen, die entlang der Strangulationsgänge leicht brechen. Weitsichtigere Gegenmaßnahmen bestehen aus mehreren Schritten. Am Anfang steht eine genaue Analyse, welche Faktoren im konkreten Fall zur Massenvermehrung geführt haben. Danach muss abgewogen werden, welche dieser Faktoren mit welchem Aufwand geändert werden können. Anschließend werden die konkreten Gegenmaßnahmen durchgeführt. Zu diesen gehören meist das Entfernen der Bäume, die am stärksten befallen sind sowie das Anpflanzen anderer Baumarten, um die Artenvielfalt zu erhöhen.
Außerhalb der südeuropäischen Gebiete, in denen die Korkeiche wirtschaftlich genutzt wird, tritt eher die Schutzwürdigkeit des Käfers in den Blickwinkel. So ist die Art beispielsweise in der Rote Liste gefährdeter Arten von Deutschland in Kategorie 1 (vom Aussterben bedroht) eingestuft.
Quellen
Literatur
- Heinz Freude, Karl Wilhelm Harde, Gustav Adolf Lohse: Die Käfer Mitteleuropas. Band 6: Diversicornia. Spektrum, Heidelberg 1979, ISBN 3-87263-027-X.
- Carl Gustav Calwer und Gustav Jäger (Hrsg.): C. G. Calwer’s Käferbuch. K. Thienemanns, Stuttgart 1876, 3. Auflage
- D. Francisco Xavier Soria Iglesias: "Estudios Biologicos sobre Coroebus undatus (Fabricius) y Coroebus florentinus (Herbst) en Alconorcales en Andalucia Occidental" Sevilla, 1990 Doktorarbeit, spanisch
- Fritz Brechtel, Hans Kostenbader (Hrsg.): Die Pracht- und Hirschkäfer Baden-Württembergs. Ulmer, Stuttgart (Hohenheim) 2002, ISBN 3-8001-3526-4.
Einzelnachweise
- Fauna Europaea: Taxonomie und Verbreitung (englisch)
- Fritz Brechtel, Hans Kostenbader (Hrsg.): Die Pracht- und Hirschkäfer Baden-Württembergs, Eugen Ulmer Verlag Stuttgart 2002, ISBN 3-8001-3526-4
- Rote Listen bei BioNetworkX
- Johann Friedrich Wilhelm Herbst: Natursystem aller bekannter in- und ausländischen Insekten, … der Käfer neunter Theil Berlin 1801 Beschreibung von Buprestis florentina in der Google-Buchsuche
- Sigmund Schenkling: Nomenclator coleopterologus 2. Auflage Jena 1922 Erklärung der wissenschaftlichen Käfernamen (Art) in Kurzform
- Carolo de Villers: Caroli Linnaei Entomologia – Faunae Suecicae descriptionibus aucta Tom.I Lugduni (Lyon) 1789 Buprestis fasciata
- Friedrich Eschscholtz: Zoologischer Atlas …. 1. Heft. Berlin 1829 Aufteilung von Buprestis S. 8
- Sigmund Schenkling: Nomenclator coleopterologus 2. Auflage Jena 1922 Erklärung der wissenschaftlichen Käfernamen (Gattung) in Kurzform
- Coraebus bei Fauna Europaea. Abgerufen am 26. März 2013
- Arten der Gattung Coraebus bei BioLib
Weblinks
- Art bei Forestpests (englisch)
- Art bei Common Forest Pests and Diseases in SW-Europe (spanisch)