Ketamin
Ketamin ist ein in Human- und Tiermedizin eingesetztes dissoziatives Anästhetikum. Seine Wirkung beruht wesentlich auf der nichtkompetitiven Hemmung von NMDA-Rezeptoren. Es bewirkt eine ausreichende Analgesie bei erhaltenem Wachzustand ohne Beeinträchtigung der Vitalfunktionen und ist aufgrund seiner therapeutischen Breite etabliert in der Katastrophenmedizin. Die psychotomimetische Wirkungkomponente veranlasst Zurückhaltung im medizinischen Einsatz, führte aber zur Verwendung als Rauschdroge. Ketamin ist in der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation aufgeführt.[5]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Ketamine_Structural_Formula_V1.svg.png.webp) | ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname |
| |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H16ClNO | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner Feststoff (Ketaminhydrochlorid)[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 237,74 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
7,5[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Das (S)-Enantiomer Esketamin wurde in jüngerer Zeit in den USA und der Europäischen Union zur Notfallbehandlung behandlungsresistenter Depression zugelassen.
Geschichte
Im Rahmen eines Forschungsauftrages der Firma Parke-Davis bei der Suche nach einem Ersatz für das mit starken Nebenwirkungen behaftete Narkosemittel Phencyclidin (PCP, „Angel Dust“) synthetisierte Calvin L. Stevens, Chemiker an der Wayne State University (Detroit, Michigan, USA), im April 1962 erstmals die Substanz Ketamin (CI-581).[6]
Im Jahr 1966 erhielt Parke-Davis ein Patent[7] für die Herstellung von Ketamin als Arzneimittel sowohl für die Humanmedizin als auch für die Tiermedizin. Edward Felix Domino, Professor für klinische Pharmakologie an der Universität in Michigan (USA), führte am 3. August 1964 seinen ersten (nichtmedizinischen) Selbstversuch mit Ketamin durch und erkannte dabei das psychedelische Potential der Substanz.[8] Die Bezeichnung dissoziatives Anästhetikum für Ketamin wurde von ihm dann im folgenden Jahr 1965 eingeführt.
Im Vietnamkrieg wurde Ketamin an amerikanischen Soldaten erprobt und bald routinemäßig als Anästhetikum bei der Behandlung von Kampfverletzungen eingesetzt. 1970 erfolgte die Zulassung als Arzneimittel durch die Food and Drug Administration. Als Straßendroge verbreitete sich Ketamin etwa ab Mitte der 1970er Jahre.
Chemie
Struktur und Stereochemie
Ketamin ist ein chirales Cyclohexanonderivat und Phenylcyclohexylamin mit einem Stereozentrum.
| Enantiomere | ||
| Name | (R)-Ketamin | (S)-Ketamin |
| Andere Namen | Erketamin | Esketamin |
| Strukturformel | -Ketamine-Structural_Formulae_V2.svg.png.webp) | |
| CAS-Nummer | 33643-49-1 | 33643-46-8 |
| EG-Nummer | – | 811-504-2 |
| ECHA-Infocard | – | 100.242.065 |
| PubChem | – | 182137 |
| Wikidata | Q20707684 | Q2365493 |
Pharmazeutisch werden die Hydrochloride des rac-Ketamins[9] und des Esketamins[10] verwendet.[11][12]
Herstellung
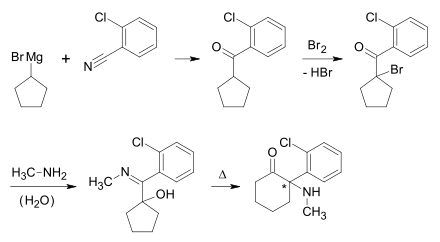
Ketamin kann hergestellt werden aus 2-Chlorbenzonitril und Cyclopentylmagnesiumbromid mittels Grignard-Reaktion, nachfolgender Halogenierung mit Brom und anschließender Kondensation mit Methylamin. Das Erhitzen in Decalin führt unter Ringerweiterung zum racemischen Ketamin.
Tracer und nächste Strukturverwandte
Ketamin ist in vielfältiger Weise, insbesondere in seinem aliphatischen Anteil, deuteriert worden, um einerseits Metaboliten massenspektroskopisch ausfindig zu machen und um andererseits Molekülpositionen durch Anwendung des kinetischen Isotopeneffekts gegenüber dem Stoffwechsel zu stabilisieren und das Wirkprofil dieser Verbindungen zu studieren.[13] Diente einst die am Methyl mit 11C markierte Verbindung als provisorischer PET-Tracer,[14] so ist seit dem Jahr 2018 ein Tracer bekannt, der an stoffwechselstabiler Position mit dem Nuklid 14C radioaktiv markiert ist.[15] Das in der Synthese verwendete 14C-Benzonitril ist per Sandmeyer-Reaktion in hoher Ausbeute zugänglich. N-Ethylnorketamin,[16] Deschlorketamin und die 2-Fluor-Entsprechung sind in den 2010er Jahren als NPS identifiziert worden.[17]
Pharmakologische Eigenschaften
Wirkmechanismus
Die Hauptwirkung des Ketamins besteht in der Porenblockade des ionotropen NMDA-Rezeptors. Das Enantiomer Esketamin ist diesbezüglich aufgrund höherer Affinität wirksamer.[18] Zusätzlich hemmt Ketamin diesen Rezeptor allosterisch.[19] Es moduliert und aktiviert GABAA-Rezeptoren der Typen α6β2δ und α6β3δ und unterscheidet sich hierin von den NMDAR-Antagonisten Phencyclidin und Dizocilpin.[20] Ketamin hat eine schwache agonistische Wirkung an Opioidrezeptoren.
Weiterhin wirkt Ketamin hemmend auf die periphere Wiederaufnahme von Katecholaminen wie Noradrenalin und Dopamin an der synaptischen Endplatte mit Verstärkung endogener und exogener Katecholamineffekte. Durch diese Mechanismen kommt es zu einer ausgeprägten Stimulation des Herz-Kreislauf-Systems, zum Beispiel zu gesteigerter Herzfrequenz, erhöhtem Blutdruck und (kurzzeitig)[21] erhöhtem Herzschlagvolumen. Durch Überstimulation des Zentralnervensystems oder Induktion eines kataleptischen Stadiums wird eine Amnesie ausgelöst. Das thalamoneocorticale System wird gedämpft, das limbische aktiviert. Ketamin wirkt auf das periphere Nervensystem sowohl depressiv (durch Blockade des Membranstroms) als auch exzitatorisch (durch Modifikation der Natrium-Kanal-Fraktion). Es hat nur geringe viscerale analgetische Effekte, dafür aber ausgeprägte somatische.
Die Ursache für die schnell einsetzende antidepressive Wirkung von Ketamin ist noch unklar. Es gibt mannigfaltige Erklärungsversuche.[22] Einer der jüngeren Ansätze erklärt diese spezielle Wirkung mit der Hemmung von NMDA-Rezeptoren in der lateralen Habenula und der Enthemmung nachgeschalteter monoaminerger Belohnungszentren.[23] Daneben rückten MikroRNAs ins Blickfeld.[24] Die Expression von miR-29b-3p im präfrontalen Kortex wird durch Ketamin erhöht, was sich günstig auf die Regulation des metabotropen Glutamatrezeptors Typ 4 auswirkt.[25] Ferner wird untersucht, inwieweit der Metabolit (2R,6R)-Hydroxynorketamin eine eigene antidepressive Wirkung hat.[26][27]
Das allgemeine pharmakologische Profil von (S)-Ketamin entspricht weitgehend dem des Racemats. Die analgetische und anästhetische Potenz von (S)-Ketamin ist etwa dreifach höher als die der (R)-Form bzw. doppelt so hoch wie die des Racemats; zur Erzielung gleichartiger Wirkungen ist mit (S)-Ketamin gegenüber dem Racemat eine Dosisreduktion um die Hälfte möglich. Darüber hinaus wird (S)-Ketamin schneller eliminiert und ist damit insgesamt besser steuerbar. Neben der reduzierten Substanzbelastung führt dies zu eindeutig verkürzten Aufwachzeiten.[28] Die unterschiedliche Wirkung von (R)- und (S)-Ketamin ist durch klinische Studien belegt.[29]
Pharmakokinetische Daten
- Nach etwa 30 Sekunden beginnt Ketamin (wie auch S-Ketamin) bei intravenöser Gabe analgetisch zu wirken. Diese Wirkung hält etwa 5 bis 15 Minuten, bei S-Ketamin 30 bis 40 Minuten, an.[30]
- Plasmahalbwertszeit: bei klinischer Gabe beträgt die terminale Eliminationshalbwertszeit für (S)-Ketaminhydrochlorid zwischen 79 Minuten (nach kontinuierlicher Infusion) und 186 Minuten (nach niedrigdosierter i.v.-Gabe),[31] bei anderen Applikationsformen zwei bis dreieinhalb Stunden.[6]
- Therapeutische Dosis: Abhängig von Zielsetzung (Analgesie, Narkose), Co-Medikation und Kreislaufsituation sowie nach Wirkung im Einzelfall anzupassen.
- Bioverfügbarkeit: oral 17 %, sublingual 33 %, intranasal 25 bis 50 %, intramuskulär 93 %.[6][32]
Klinische Anwendung
Anästhesie und Analgesie
Ketamin ist als Allgemeinanästhetikum zur Einleitung und Durchführung einer Vollnarkose, als Ergänzung bei Regionalanästhesien und als Anästhetikum und Analgetikum in der Notfallmedizin zugelassen. Es kann intravenös, intramuskulär und nasal verabreicht werden.[33] In der Allgemeinanästhesie wird es bei Erwachsenen oft in Kombination mit einem Schlafmittel (Hypnotikum), beispielsweise aus der Gruppe der Benzodiazepine, eingesetzt, während in der Kinderchirurgie und in der Notfallmedizin der Einsatz ohne Hypnotika überwiegt.[34]
Auf Grund seiner bronchienerweiternden Eigenschaften ist Ketamin in Kombination mit einem Muskelrelaxans auch zur Intubation bei einem therapieresistenten Status asthmaticus zugelassen. Hierbei werden mit 1 bis 2 und bei Bedarf bis zu fünf Milligramm pro Kilogramm Körpergewicht vergleichbar höhere Ketamindosen eingesetzt.[34] Für eine niedrigdosierte Anwendung außerhalb der Zulassung (Off-Label-Use) bei Erwachsenen mit einem akuten Asthmaanfall gibt es keine ausreichenden Belege.[35] Abgesehen von Einzelfallberichten gibt es auch keine Hinweise auf eine Wirksamkeit von Ketamin für eine Anwendung bei einem akuten Asthmaanfall bei Kindern.[36]
Ein weiteres zugelassenes Anwendungsgebiet von Ketamin ist die Schmerzbehandlung (Analgesie) intubierter Intensivpatienten.[34]
Ketamin findet auch in der Veterinärmedizin (zum Beispiel in Kombination mit Xylazin in der Hellabrunner Mischung) und in der Pädiatrie Anwendung. Ketamin kann nasal, oral, intravenös sowie intramuskulär verabreicht werden.
Ketamin ist sowohl ein schlaferzeugendes Mittel (Hypnotikum) als auch ein potentes Analgetikum. Charakteristisch für seine Wirkung ist die Erzeugung einer dissoziativen Anästhesie, d. h. die Erzeugung von Schlaf und Schmerzfreiheit unter weitgehender Erhaltung der Reflextätigkeit, auch der Schutzreflexe. Damit entfällt insbesondere die bei anderen Anästhetika bestehende Gefahr eines lebensbedrohenden Atemstillstands, damit verbunden die Notwendigkeit der Atem- und Kreislaufüberwachung mit entsprechendem Apparate- und Personalaufwand.
Therapie der Depression
Eine Studie von 2010 mit 18 Teilnehmern erforschte die intravenöse Gabe von Ketamin, welche die depressiven Episoden bei Patienten mit bipolarer Störung binnen 40 Minuten beendete. Die Wirkung war jedoch nicht von Dauer.[37][38]
Eine Studie aus dem Jahr 2013 mit 26 Teilnehmern beschrieb anhaltende antidepressive Wirkungen von niedrigen sublingualen Ketamindosen bei hartnäckigen Depressionen und Depressionen im Rahmen der bipolaren Störung. Bei 20 Teilnehmern (77 %) zeigte sich eine beständige Stimmungsaufhellung sowie verbesserter Schlaf. Es wurden dabei alle zwei bis drei Tage bzw. wöchentlich zehn Milligramm (RS)-(±)-Ketamin sublingual eingenommen, wobei sich als Nebenwirkung eine leichte Benommenheit – jedoch keine Euphorie oder Dissoziation – bemerkbar machte.[39]
Untersuchungen aus dem Jahr 2014 an der Charité weisen aufgrund der schnellen therapeutischen Wirkung auf eine geeignete Einsatzmöglichkeit für die Akutbehandlung therapieresistenter und vor allem suizidgefährdeter depressiver Patienten hin.[40]
In einer Studie aus dem Jahr 2014 mit 21 Patienten (bipolare Störung) wurden durch bildgebende Verfahren Effekte durch Ketamin in Gehirnregionen registriert, die besondere Bedeutung bei Depressionen haben. Unter anderem war die Besserung der Symptome durch Ketamin signifikant korreliert mit Änderungen im rechten ventralen Striatum.[41]
Eine Metaanalyse aus dem Jahr 2015 von acht randomisierten kontrollierten Studien bestätigte die Wirkung von Ketamin nach einmaliger Gabe zur sofortigen Behandlung uni- und bipolarer Depression.[42] Nach einer weiteren Metaanalyse von 2015 führte eine einmalige Gabe zu einer signifikanten Besserung über einen Zeitraum von mindestens sieben Tagen.[43] Eine Übersicht von 2015 über neun Einzelstudien zur Behandlung von insgesamt 137 Patienten mit Suizidgefährdung (Suizidalität) berichtete über eine schnelle Besserung (ab 40 Minuten) in jeder der neun Einzelstudien.[44]
Verschiedene Studien in den USA untersuchen das Potential des Ketamins bei einer schweren Depression, behandlungsresistenten Depressionen sowie bei Angstgefühlen und Depressionen bei Krebspatienten (Stand: 2015).[45][46][47][48]
Am 12. Februar 2019 empfahl ein unabhängiger Expertenausschuss der US Food and Drug Administration die Zulassung des enantiomerenreinen Eutomers (S)-Ketamin (Freiname: Esketamin) als Nasenspray zur Behandlung von behandlungsresistenter Depression,[49][50] im März 2019 folgte die Zulassung als Spravato.[51] Seit Dezember 2019 ist Spravato in der europäischen Union zur Behandlung der behandlungsresistenten Depression zugelassen.[52] Später wurde das Anwendungsgebiet erweitert um die akute Kurzzeittherapie bei Erwachsenen mit einer mittelgradigen bis schweren depressiven Episode zur schnellen Reduktion depressiver Symptome, die nach ärztlichem Ermessen einen psychiatrischen Notfall darstellen (Juli 2020 in USA, Februar 2021 in der EU). In jedem Fall erfolgt die Anwendung in Kombination mit der medikamentösen Behandlung mit oralen Antidepressiva; Anwendung und Nachbeobachtung müssen in einem geeigneten medizinischen Umfeld stattfinden.[53][51]
Neben- und Wechselwirkungen
Als sehr häufige Nebenwirkungen können psychotrope Effekte (Pseudohalluzinationen, unangenehme Träume), Übelkeit und Erbrechen, erhöhter Speichelfluss (Hypersalivation), Sehstörungen, Schwindel und motorische Unruhe auftreten. Daneben wirkt Ketamin als einziges Narkotikum blutdruck- und herzfrequenzsteigernd; dies ist bei spezifischen Indikationen erwünscht. Im Rahmen der Notfallmedizin ist es das einzige Medikament, mit dessen Einsatz kreislaufstabilisierende und narkotische Effekte kombiniert werden können. Der Einsatz bei Patienten mit schwerer koronarer Herzerkrankung (zum Beispiel Herzinfarkt) ist hingegen abzulehnen, weil das Medikament durch Herzfrequenz- und Blutdruckanhebung die Herzarbeit steigert und somit den Sauerstoffverbrauch des Herzmuskels erhöht.
Ketamin bewirkt eine Erhöhung von Augen- und Hirndruck, weshalb es bei Verletzungen dort nicht als einziges Anästhetikum eingesetzt werden sollte.[54] Der Muskeltonus der Kehlkopfmuskulatur bleibt unter Ketamin erhalten. Ein sicherer Aspirationsschutz besteht jedoch nicht. In höheren Dosierungen wirkt Ketamin ebenso bronchospasmolytisch.[55] Ketamin als Notfallmedikation kann das Risiko einer Posttraumatischen Belastungsstörung erhöhen.[56] In der Routineanästhesie wird Ketamin aufgrund der psychotropen Nebenwirkungen weitgehend abgelehnt. Die Kombination mit einem Benzodiazepin kann aber das Auftreten von Albträumen und Halluzinationen teilweise verhindern. Eine Reizabschirmung ist ebenfalls sinnvoll.
Experimentelle Behandlung der Tollwut
Ketamin gehört wie Midazolam zum sogenannten Milwaukee-Protokoll, einem experimentellen Behandlungsschema bei einer Tollwut-Erkrankung. Dabei wird der Patient in ein künstliches Koma versetzt. Versuche mit Zellkulturen wie auch an Ratten hatten gezeigt, dass Ketamin die virale Gen-Transkription in den Nervenzellen verlangsamt.[57] Wie auch bei anderen Substanzen konnte für Ketamin noch keine klinische Wirksamkeit gegen Tollwut beim Menschen nachgewiesen werden.[58] Dennoch ergeben sich daraus für die pharmakologische Forschung Hinweise auf mögliche Zielmoleküle.
Verwendung als Rauschmittel
Akute psychologische Effekte
Aufgrund seiner dissoziativen Wirkung wird Ketamin auch weltweit als Rauschdroge verwendet.[59]
In niedrigen Dosierungen induziert Ketamin eine Verzerrung des Raum- und Zeitempfindens, Pseudohalluzinationen sowie milde dissoziative Effekte. Ketaminkonsumenten gaben an, dass die besonders erwünschten Effekte in einer „Verschmelzung mit der Umgebung“ (‘melting into the surroundings’), visuellen Halluzinationen, außerkörperlichen Erfahrungen und Albernheit bestanden. Die psychoaktiven Effekte, die mit der Rauschwirkung von Ketamin einhergehen (Derealisation, Depersonalisation, auditive sowie visuelle Halluzinationen, ungewöhnliche Gedankeninhalte, Euphorie, verstärkte Farbwahrnehmung, Verlust des Zeitgefühls sowie neuartige Körperempfindungen) wurden im Allgemeinen als positiv eingestuft. Allerdings gaben 20 % aller Ketaminkonsumenten an, dass derartige Effekte unerwünscht und psychisch belastend seien. Zudem gaben 38 % an, eine Person zu kennen, die bereits schlechte Erfahrung mit Ketamin gemacht hat.[59] John Cunningham Lilly und David Woodard (unter anderem) haben ausführlich über ihre eigenen psychonautischen Erfahrungen mit Ketamin geschrieben.[60]:288–295
Die Aufwach-Erscheinungen nach einer Anwendung zur Narkose, die bei Ketamin vorkommen, können Wahngedanken, Halluzinationen, Delir, Verwirrtheit, gelegentlich aber auch außerkörperliche Erfahrungen sowie Nahtoderfahrungen beinhalten. Der klinische Einsatz von Ketamin wurde deshalb von jeher durch derartige Symptome eingeschränkt, doch wurde dadurch auch ab den 1960er-Jahren das Interesse an einer Verwendung als Rauschdroge geweckt.[59] Zu den teils erwünschten, teils unangenehmen und angsteinflößenden Wirkungen zählt das K-Hole (Ketamin-Loch), eine etwa 30-minütige komplette Dissoziation von der Realität. Hierbei können Ataxie, Dysarthrie, muskuläre Hypertonie sowie Myoklonie auftreten.[61] Äußerlich gleicht der Zustand häufig einer Bewusstlosigkeit. Das Risiko eines K-Holes wurde mit erhöhtem Ketaminkonsum in Verbindung gebracht, insbesondere bei Nutzern, die Ketamin mehr als 20-mal konsumiert hatten. Die Anwesenheit anderer Personen (etwa Freunde, Personal in Clubs oder auf Festivals) kann dabei helfen, mit der Erfahrung umzugehen.[59]
Risiken
Es besteht das Risiko einer psychischen Abhängigkeit, wenn Ketamin für längere Zeit nichtmedizinisch verwendet wird.[62] Sporadischer Ketaminkonsum ist nicht mit kognitiven Einschränkungen behaftet, chronischer Gebrauch verursacht allerdings erhebliche Beeinträchtigungen des Kurz- und Langzeitgedächtnisses; ob diese reversibel sind, ist noch offen (Stand: 2013).[59]
Ketamin hat eine große therapeutische Breite, sodass eine Überdosierung schwierig bzw. kaum möglich ist. Die mittlere letale Dosis (LD50), die bei Tieren beobachtet wurde, ist etwa die 100fache der durchschnittlichen menschlichen intravenösen Dosis und das 20fache der durchschnittlichen menschlichen intramuskulären Dosis, die im klinischen Umfeld zur Narkose benutzt wird.[6]
Weiterhin kann Ketamin bei längerfristigem Gebrauch die ableitenden Harnwege schädigen. Es kann zu urologischen Beschwerden (LUTS) und zu einer Blasenentzündung mit Bildung von Geschwüren (ulzerative Zystitis) kommen.[63][64][65] Die Symptome sind meist reversibel, falls der Ketamingebrauch eingestellt wird, bei chronischem Gebrauch sind jedoch Operationen nötig.[59][66][67]
Die dissoziative Wirkung von Ketamin kann Nutzer in einen Zustand versetzen, in dem sie verwundbar sind durch Unfälle, Raub, Überfall und Vergewaltigung. In einer Studie mit neunzig Ketamin-Nutzern berichteten 13 %, dass sie als direkte Folge des Ketaminrausches in einen Unfall verwickelt waren, 83 % kannten jemanden, der einen Unfall durch Ketaminkonsum erlitt.[59]
Eine magnetresonanztomographische Untersuchung an 21 chronischen Ketaminkonsumenten zeigte bei allen Probanden Hirnschäden, deren Schwere mit Dauer des Konsums korrelierten.[68] Leichte Schäden waren bereits nach einem halben Jahr täglichen Konsums (1 g/Tag) nachweisbar. Während zunächst nur die Weiße Substanz der Großhirnrinde oberflächlich betroffen war, breiteten sich die Läsionen bei längerer Einnahme (ab 1–3 Jahre) auch auf tiefere Hirnareale, wie die Capsula interna und wenig später dem Pons und das Kleinhirn aus. Bei Probanden mit 4–5 Jahren Konsum waren schließlich auch das limbische System und das Stammhirn betroffen. Die Schäden wurden in diesem Stadium – mit fünf oder mehr betroffenen Regionen – als „schwer“ eingestuft. Mischkonsum mit anderen Drogen oder höhere Tagesdosen stehen in Verdacht, die schädigende Wirkung zu verstärken.
Statistik
Öffentliche Daten für den Gebrauch von Ketamin als Rauschdroge lagen bis 2011 für Frankreich, Großbritannien, Italien, Tschechien und Ungarn vor.[69]
Der Europäische Drogenbericht 2015 der Europäischen Beobachtungsstelle für Drogen und Drogensucht (EMCDDA) erwähnt eine nicht-repräsentative Online-Befragung mit 25.790 Teilnehmern zwischen 15 und 34 Jahren, die regelmäßig an „Veranstaltungen des Nachtlebens“ teilnahmen, nach der in zehn europäischen Ländern die 12-Monats-Prävalenz des Konsums von Ketamin hinter der von Cannabis, MDMA, Kokain und Amphetamin lag.[70] Im Vereinigten Königreich gab es von 1997 bis April 2013 nach amtlicher Statistik 93 Todesfälle in Verbindung mit dem Gebrauch von Ketamin als Rauschmittel. Von den 93 Personen waren 86 % männlich, und das Durchschnittsalter betrug 30,9 Jahre (15,8 bis 60,6 Jahre). Bei 70 dieser Fälle war eine zusätzliche Droge (wie etwa Alkohol) beteiligt.[59]
Rechtslage
In Deutschland, der Schweiz und Österreich ist Ketamin verschreibungspflichtig.
In Großbritannien hat der zunehmende Gebrauch von Ketamin als Droge die Regierung veranlasst, das Medikament seit Januar 2006 als Droge der Klasse C einzustufen.[71] Da in der Folgezeit die Schäden noch höher waren als erwartet, wurde die Klassifizierung 2014 verschärft und die Substanz in Klasse B hochgestuft.[72] Der illegale private Besitz ist dort seitdem mit bis zu fünf Jahren Haft strafbar, statt mit bis zu zwei Jahren (seit 2006). Der illegale Handel kann weiterhin mit bis zu 15 Jahren Haft bestraft werden. Mittlerweile wird Ketamin auch in Ländern, in denen es bisher frei erhältlich war (zum Beispiel Indien), unter Restriktion gestellt.
Handelsnamen
Ketalar (CH), Ketanest S (Wirkstoff Esketamin, D), zahlreiche Generika
Tiermedizin: Anesketin, Ketaset, Ketavet, Narketan, Ursotamin
Literatur
(chronologisch geordnet)
- Monographien
- David T. Yew: Ketamine. Use and Abuse. CRC Press 2015, ISBN 1-4665-8339-8.
- Stephen J. Hyde: Ketamine for Depression. Xlibris Corporation, Bloomington (IN) USA 2015, ISBN 1-5035-0953-2.
- Advisory Council on the Misuse of Drugs: Ketamine: a review of use and harm. (PDF; 971 kB) Bericht für den britischen Innen- und Gesundheitsminister, London, 10. Dezember 2013.
- Karl Jansen: Ketamine : Dreams and Realities. MAPS 2004, ISBN 0966001974.
- Friedrich Wilhelm Ahnefeld, Ernst Pfenninger (Hrsg.): Ketamin in der Intensiv- und Notfallmedizin. Springer Verlag, Berlin Heidelberg 1989, ISBN 3-642-74144-4.
- Artikel
- M. A. Peltoniemi, N. M. Hagelberg, K. T. Olkkola, T. I. Saari: Ketamine: A Review of Clinical Pharmacokinetics and Pharmacodynamics in Anesthesia and Pain Therapy. In: Clinical Pharmacokinetics. Band 55, Nummer 9, September 2016, S. 1059–1077, doi:10.1007/s40262-016-0383-6, PMID 27028535 (Review).
- T. A. Henderson: Practical application of the neuroregenerative properties of ketamine: real world treatment experience. In: Neural regeneration research. Band 11, Nummer 2, Februar 2016, S. 195–200, doi:10.4103/1673-5374.177708, PMID 27073354, PMC 4810965 (freier Volltext) (Review).
- C. J. Morgan, H. V. Curran: Ketamine use: a review. In: Addiction. Band 107, Nummer 1, Januar 2012, S. 27–38, doi:10.1111/j.1360-0443.2011.03576.x, PMID 21777321 (Review).
- B. Sinner, B. M. Graf: Ketamine. In: Handbook of experimental pharmacology. Nummer 182, 2008, S. 313–333, doi:10.1007/978-3-540-74806-9_15, PMID 18175098 (Review).
- Karl Jansen: A review of the nonmedical use of ketamine: use, users and consequences. In: Journal of psychoactive drugs. Band 32, Nummer 4, 2000 Oct-Dec, S. 419–433, doi:10.1080/02791072.2000.10400244, PMID 11210204 (Review).
- Karl Jansen, R. Darracot-Cankovic: The nonmedical use of ketamine, part two: A review of problem use and dependence. In: Journal of psychoactive drugs. Band 33, Nummer 2, 2001 Apr–Jun, S. 151–158, doi:10.1080/02791072.2001.10400480, PMID 11476262 (Review).
Weblinks
- Roland Seifert, Lutz Hein: Ketamin zur Behandlung von Depression und Suizidalität,. (PDF) In: BIOspektrum, 4/2015, 21. Jahrgang, S. 419, Springer-Verlag, Wissenschaft Aktuell; abgerufen am 17. Oktober 2015.
- Volkart Wildermuth: Depression: Auf der Suche nach Alternativen für Ketamin (Text und Audio). Deutschlandfunk Forschung aktuell, 9. Juni 2015; abgerufen am 16. Oktober 2015.
- Janna Lawrence: The secret life of ketamine. In: The Pharmaceutical Journal, the official weekly journal of the Royal Pharmaceutical Society, 19. März 2015, Vol 294, No 7854/5; abgerufen am 17. Oktober 2015.
- Ketamine lifts depression via a byproduct of its metabolism. In: nih.gov. 4. Mai 2016, abgerufen am 7. Mai 2016 (englisch).
- Rachel Wright: Ketamine: why not everyone wants a ban. BBC News, 13. März 2015, zur Bedeutung von Ketamin als unersetzliches Narkotikum in weiten Gebieten der weniger entwickelten Welt, abgerufen am 18. Oktober 2015.
- Wie Ketamin die Depressionen zügelt. In: Deutsches Ärzteblatt. 20. Februar 2018, abgerufen am 15. August 2018.
Einzelnachweise
- Datenblatt (±)-Ketamine hydrochloride bei Sigma-Aldrich, abgerufen am 4. Dezember 2021 (PDF).
- Eintrag zu Ketamine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 916–917, ISBN 978-0-911910-00-1.
- Eintrag zu Ketamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juli 2019.
- [April 2013]WHO Model List of Essential Medicines, 18th. Auflage, World Health Organization, October 2013, S. 1 [p. 5 of pdf] (Abgerufen am 22. April 2014).
- B. Sinner, B. M. Graf: Ketamine. In: Handbook of experimental pharmacology. Nummer 182, 2008, S. 313–333, doi:10.1007/978-3-540-74806-9_15, PMID 18175098 (Review).
- Patent US3254124.
- Vgl. auch A. Benke, W. Unger: Psychische und vestibuläre Effekte von Ketamine. In: H. Kreuscher (Hrsg.): Anaesthesiologie und Wiederbelebung. Band 40. Springer, Berlin/ Heidelberg/ New York 1969, S. 167–169.
- Externe Identifikatoren von bzw. Datenbank-Links zu (RS)-Ketamin-Hydyrochlorid: CAS-Nummer: 1867-66-9, EG-Nummer: 217-484-6, ECHA-InfoCard: 100.015.895, PubChem: 15851, ChemSpider: 15065, DrugBank: DBSALT000396, Wikidata: Q27105184.
- Externe Identifikatoren von bzw. Datenbank-Links zu Esketamin-Hydrochlorid: CAS-Nummer: 33643-47-9, EG-Nummer: 687-681-3, ECHA-InfoCard: 100.213.809, PubChem: 44632368, ChemSpider: 26332012, DrugBank: DBSALT002086, Wikidata: Q27128597.
- Eintrag zu Ketamine in der DrugBank der University of Alberta, abgerufen am 18. Juni 2019.
- Eintrag zu Esketamine in der DrugBank der University of Alberta, abgerufen am 18. Juni 2019.
- Turfus SC, Parkin MC, Cowan DA, Halket JM, Smith NW, Braithwaite RA, Elliot SP, Steventon GB, Kicman AT: Use of human microsomes and deuterated substrates: an alternative approach for the identification of novel metabolites of ketamine by mass spectrometry. In: Drug Metab Dispos. 37, Nr. 8, 2009, S. 1769–78. doi:10.1124/dmd.108.026328. PMID 19448136. PMC 2712439 (freier Volltext).
- Kumlien E, Hartvig P, Valind S, Oye I, Tedroff J, Långström B: NMDA-receptor activity visualized with (S)-[N-methyl-11C]ketamine and positron emission tomography in patients with medial temporal lobe epilepsy. In: Epilepsia. 40, Nr. 1, 1999, S. 30–7. doi:10.1111/j.1528-1157.1999.tb01985.x. PMID 9924899.
- Chen L, Gong Y, Salter R: Synthesis of carbon-14 labeled ketamine and norketamine. In: J Labelled Comp Radiopharm. 61, Nr. 11, 2018, S. 864–868. doi:10.1002/jlcr.3669. PMID 29992626.
- L. V. Sayson, C. J. Botanas, R. J. P. Custodio et al.: The novel methoxetamine analogs N-ethylnorketamine hydrochloride (NENK), 2-MeO-N-ethylketamine hydrochloride (2-MeO-NEK), and 4-MeO-N-ethylketamine hydrochloride (4-MeO-NEK) elicit rapid antidepressant effects via activation of AMPA and 5-HT2 receptors. In: Psychopharmacology (Berl). 236, Nr. 7, 2019, S. 2201–2210. doi:10.1007/s00213-019-05219-x. PMID 30891619.
- M. H. Y. Tang, T. C. Li, C. K. Lai, Y. K. Chong, C. K. Ching, T. W. L. Mak: Emergence of new psychoactive substance 2-fluorodeschloroketamine: Toxicology and urinary analysis in a cluster of patients exposed to ketamine and multiple analogues. In: Forensic Sci Int. 312, 2020, S. 110327. doi:10.1016/j.forsciint.2020.110327. PMID 32460225.
- Hirota K, Lambert DG: Ketamine: its mechanism(s) of action and unusual clinical uses. In: Br J Anaesth. 77, Nr. 4, 1996, S. 441–4. PMID 8942324.
- BA Orser, PS Pennefather, JF MacDonald: Multiple mechanisms of ketamine blockade of N-methyl-D-aspartate receptors. In: Anesthesiology. 86, Nr. 4, 1997, S. 903–17. PMID 9105235.
- W Hevers, SH Hadley, H Lüddens, J Amin: Ketamine, but not phencyclidine, selectively modulates cerebellar GABA(A) receptors containing alpha6 and delta subunits. In: J. Neurosci.. 28, Nr. 20, 2008, S. 5383–5393. doi:10.1523/JNEUROSCI.5443-07.2008. PMID 18480294.
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin / Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 22 f.
- SE Strasburger, PM Bhimani, JH Kaabe u. a.: What is the mechanism of Ketamine’s rapid-onset antidepressant effect? A concise overview of the surprisingly large number of possibilities. In: J Clin Pharm Ther. 42, Nr. 2, 2017, S. 147–154. doi:10.1111/jcpt.12497. PMID 28111761.
- Y Yang, Y Cui, K Sang, Y Dong, Z Ni, S Ma, H Hu: Ketamine blocks bursting in the lateral habenula to rapidly relieve depression. In: Nature. 554, Nr. 7692, 2018, S. 317–322. doi:10.1038/nature25509. PMID 29446381.
- Artigas F, Celada P, Bortolozzi A: Can we increase the speed and efficacy of antidepressant treatments? Part II. Glutamatergic and RNA interference strategies. In: Eur Neuropsychopharmacol. 28, Nr. 4, April 2018, S. 457–482. doi:10.1016/j.euroneuro.2018.01.005. PMID 29525411.
- YQ Wan, JG Feng, M Li, MZ Wang, L Liu, X Liu, XX Duan, CX Zhang, XB Wang: Prefrontal cortex miR-29b-3p plays a key role in the antidepressant-like effect of ketamine in rats. In: Exp. Mol. Med.. 50, Nr. 10, 2018, S. 140. doi:10.1038/s12276-018-0164-4. PMID 30369596. PMC 6204429 (freier Volltext).
- Chaki S, Yamaguchi JI: Now is the time for (2R,6R)-hydroxynorketamine to be viewed independently from its parent drug. In: Pharmacol. Biochem. Behav.. 175, 2018, S. 24–26. doi:10.1016/j.pbb.2018.09.005. PMID 30201385.
- JN Highland, PJ Morris, P Zanos u. a.: Mouse, rat, and dog bioavailability and mouse oral antidepressant efficacy of ( 2R,6R)-hydroxynorketamine. In: J. Psychopharmacol. (Oxford). 2018, S. 269881118812095. doi:10.1177/0269881118812095. PMID 30488740.
- H.A. Adams, C. Werner: Vom Racemat zum Eutomer: (S)-Ketamin – Renaissance einer Substanz? In: Anaesthesist, Band 46, 1997, S. 1026–1042. PMID 9451486 doi:10.1007/s001010050503
- G. Hempelmann, D. F. M. Kuhn: Klinischer Stellenwert des S-(+)-Ketamin. In: Der Anaesthesist, Band 46, 1997, S. S3–S7, doi:10.1007/PL00002461.
- D. Häske, M. Bernhard und andere: Analgesie bei Traumapatienten in der Notfallmedizin. In: Der Anaesthesist. Band 69, Nr. 2, Februar 2020, S. 137–148, hier: S. 141.
- Ketanest® S Fachinformation (PDF).
- J. A. Clements, W. S. Nimmo, I. S. Grant: Bioavailability, pharmacokinetics, and analgesic activity of ketamine in humans. In: Journal of pharmaceutical sciences. Band 71, Nummer 5, Mai 1982, S. 539–542, PMID 7097501.
- D. Häske und andere: Analgesie bei Traumapatienten in der Notfallmedizin. In: Der Anaesthesist. Band 69, Nr. 2, Februar 2020, S. 137–148, hier: S. 141.
- Fachinformation Ketamin-ratiopharm 50/100/500 mg O.K. Injektionslösung, Ketamin-ratiopharm 500 mg/10 ml Injektionslösung. Ratiopharm GmbH. Stand Februar 2010.
- SM Burburan, DG Xisto, PR Rocco: Anaesthetic management in asthma. In: Minerva Anestesiol. 73, Nr. 6, Juni 2007, S. 357–365. PMID 17115010.
- Jat KR, Chawla D: Ketamine for management of acute exacerbations of asthma in children. In: Cochrane Database Syst Rev. 11, 2012, S. CD009293. doi:10.1002/14651858.CD009293.pub2. PMID 23152273.
- Bipolare Störung: Ketamin durchbricht Depression (Seite nicht mehr abrufbar, Suche in Webarchiven) , Deutsches Ärzteblatt vom 3. August 2010.
- N. Diazgranados, L. Ibrahim, N. E. Brutsche, A. Newberg, P. Kronstein, S. Khalife, W. A. Kammerer, Z. Quezado, D. A. Luckenbaugh, G. Salvadore, R. Machado-Vieira, H. K. Manji, C. A. Zarate: A randomized add-on trial of an N-methyl-D-aspartate antagonist in treatment-resistant bipolar depression. In: Archives of General Psychiatry. Band 67, Nummer 8, August 2010, S. 793–802, doi:10.1001/archgenpsychiatry.2010.90. PMID 20679587. PMC 3000408 (freier Volltext).
- D. R. Lara, L. W. Bisol, L. R. Munari: Antidepressant, mood stabilizing and procognitive effects of very low dose sublingual ketamine in refractory unipolar and bipolar depression. In: The international journal of neuropsychopharmacology / official scientific journal of the Collegium Internationale Neuropsychopharmacologicum. Band 16, Nummer 9, Oktober 2013, S. 2111–2117, doi:10.1017/S1461145713000485, PMID 23683309.
- Ketamin ist die neue Hoffnung für Depressive. Die Welt, 10. März 2014, abgerufen am 15. März 2014.
- A. C. Nugent, N. Diazgranados, P. J. Carlson, L. Ibrahim, D. A. Luckenbaugh, N. Brutsche, P. Herscovitch, W. C. Drevets, C. A. Zarate: Neural correlates of rapid antidepressant response to ketamine in bipolar disorder. In: Bipolar disorders. Band 16, Nummer 2, März 2014, S. 119–128, doi:10.1111/bdi.12118, PMID 24103187, PMC 3949142 (freier Volltext).
- A. McGirr, M. T. Berlim, D. J. Bond, M. P. Fleck, L. N. Yatham, R. W. Lam: A systematic review and meta-analysis of randomized, double-blind, placebo-controlled trials of ketamine in the rapid treatment of major depressive episodes. In: Psychological medicine. Band 45, Nummer 4, März 2015, S. 693–704, doi:10.1017/S0033291714001603, PMID 25010396 (Review).
- C. M. Coyle, K. R. Laws: The use of ketamine as an antidepressant: a systematic review and meta-analysis. In: Human psychopharmacology. Band 30, Nummer 3, Mai 2015, S. 152–163, doi:10.1002/hup.2475, PMID 25847818 (Review).
- L. Reinstatler, N. A. Youssef: Ketamine as a potential treatment for suicidal ideation: a systematic review of the literature. In: Drugs in R&D. Band 15, Nummer 1, März 2015, S. 37–43, doi:10.1007/s40268-015-0081-0, PMID 25773961, PMC 4359177 (freier Volltext) (Review).
- A Study to Evaluate the Safety and Efficacy of Intranasal Esketamine in Treatment-resistant Depression. In: clinicaltrials.gov. 25. November 2013, abgerufen am 13. April 2015.
- Oral Ketamine in the Treatment of Depression and Anxiety in Patients With Cancer. In: clinicaltrials.gov. 12. April 2015, abgerufen am 13. April 2015.
- A Study of Ketamine in Patients With Treatment-resistant Depression. In: clinicaltrials.gov. 22. Juni 2012, abgerufen am 13. April 2015.
- Rapid Antidepressant Effects of Ketamine in Major Depression. In: clinicaltrials.gov. 30. Juli 2004, abgerufen am 13. April 2015.
- Cynthia Koons, Anna Edney: First Big Depression Advance Since Prozac Nears FDA Approval. In: Bloomberg News. 12. Februar 2019, abgerufen am 12. Februar 2019 (englisch).
- FDA Briefing Document – Psychopharmacologic Drugs Advisory Committee (PDAC) and Drug Safety and Risk Management (DSaRM) Advisory Committee Meeting, February 12, 2019. Agenda Topic: The committees will discuss the efficacy, safety, and risk-benefit profile of New Drug Application (NDA) 211243, esketamine 28 mg single-use nasal spray device, submitted by Janssen Pharmaceuticals, Inc., for the treatment of treatment-resistant depression. (PDF) In: Food and Drug Administration. 12. Februar 2019, abgerufen am 13. Februar 2019 (englisch).
- FDA Approved Drug Products - New Drug Application (NDA): 211243, abgerufen am 24. Februar 2021.
- Spravato Informationsseite. European Medicines Agency, 18. Dezember 2019, abgerufen am 14. April 2020 (englisch).
- Union Register of medicinal products for human use Product information Spravato. European Commission, abgerufen am 24. Februar 2021 (englisch).
- Fachinformation S-Ketanest, Stand Juni 2008.
- Wolfram Wilhelm, Marc Wrobel: Atemwegsmanagement, Narkose und Notfallbeatmung, in Wolfram Wilhelm (Hrsg.): Praxis der Intensivmedizin, 2. Auflage, Heidelberg, 2013, S. 10.
- M. Schönenberg, U. Reichwald, G. Domes, A. Badke, M. Hautzinger: Effects of peritraumatic ketamine medication on early and sustained posttraumatic stress symptoms in moderately injured accident victims. In: Psychopharmacology. Band 182, Nummer 3, November 2005, S. 420–425, doi:10.1007/s00213-005-0094-4, PMID 16012867.
- B. P. Lockhart, N. Tordo, H. Tsiang: Inhibition of rabies virus transcription in rat cortical neurons with the dissociative anesthetic ketamine. In: Antimicrobial agents and chemotherapy. Band 36, Nummer 8, August 1992, S. 1750–1755, PMID 1416859, PMC 192041 (freier Volltext).
- Zhaochen Luo, Dayong Tian, Ming Zhou, Wenjie Xiao, Yachun Zhang, Mingming Li, Baokun Sui, Wei Wang, Huashi Guan, Huanchun Chen, Zhen F. Fu, Ling Zhao, Matthias Johannes Schnell: λ-Carrageenan P32 Is a Potent Inhibitor of Rabies Virus Infection. In: PLOS ONE. 10, 2015, S. e0140586, doi:10.1371/journal.pone.0140586.
- Advisory Council on the Misuse of Drugs (Großbritannien): Ketamine: a review of use and harm. (PDF; 971 kB) Bericht für den Innenminister und den Gesundheitsminister, London, 10. Dezember 2013, (abgerufen am 13. Oktober 2015).
- Woodard, D.: „The Ketamine Necromance“. In: Parfrey, A. (Hg.), Apocalypse Culture II. Los Angeles: Feral House, 2000, S. 288–295.
- MSD Sharp & Dohme GmbH, Haar (Hrsg.): Das MSD Manual der Diagnostik und Therapie. 7. Auflage. Urban & Fischer in Elsevier, München u. a. 2007, ISBN 978-3-437-21761-6, S. 2066.
- K. L. Jansen, R. Darracot-Cankovic: The nonmedical use of ketamine, part two: A review of problem use and dependence. In: Journal of psychoactive drugs. Band 33, Nummer 2, 2001 Apr-Jun, S. 151–158, doi:10.1080/02791072.2001.10400480, PMID 11476262 (Review).
- M. C. Grégoire, D. L. MacLellan, G. A. Finley: A pediatric case of ketamine-associated cystitis (Letter-to-the-Editor RE: Shahani R, Streutker C, Dickson B, et al: Ketamine-associated ulcerative cystitis: a new clinical entity. Urology 69: 810-812, 2007). In: Urology. Band 71, Nummer 6, Juni 2008, S. 1232–1233, doi:10.1016/j.urology.2007.11.141, PMID 18455768.
- J. Yek, P. Sundaram, H. Aydin, T. Kuo, L. G. Ng: The clinical presentation and diagnosis of ketamine-associated urinary tract dysfunction in Singapore. In: Singapore medical journal. Band 56, Nummer 12, Dezember 2015, S. 660–664, doi:10.11622/smedj.2015185, PMID 26702160, PMC 4678404 (freier Volltext).
- C. H. Chen, M. H. Lee, Y. C. Chen, M. F. Lin: Ketamine-snorting associated cystitis. In: Journal of the Formosan Medical Association = Taiwan yi zhi. Band 110, Nummer 12, Dezember 2011, S. 787–791, doi:10.1016/j.jfma.2011.11.010, PMID 22248834 (Review).
- S. Middela, I. Pearce: Ketamine-induced vesicopathy: a literature review. In: International journal of clinical practice Band 65, Nummer 1, Januar 2011, S. 27–30, doi:10.1111/j.1742-1241.2010.02502.x. PMID 21155941.
- R. Hoffman u. a.: Ketamine poisoning. UpToDate 19.1, Januar 2011.
- Chunmei Wang, Dong Zheng, Jie Xu, Waiping Lam, D. T. Yew: Brain damages in ketamine addicts as revealed by magnetic resonance imaging. In: Frontiers in Neuroanatomy. Band 7, 2013, doi:10.3389/fnana.2013.00023 (frontiersin.org [abgerufen am 30. August 2017]).
- S. S. Kalsi, D. M. Wood, P. I. Dargan: The epidemiology and patterns of acute and chronic toxicity associated with recreational ketamine use. In: Emerging health threats journal. Band 4, 2011, S. 7107, PMID 24149025, PMC 3168228 (freier Volltext) (Review).
- Europäische Beobachtungsstelle für Drogen und Drogensucht: Europäischer Drogenbericht 2015 (Memento vom 12. August 2015 im Internet Archive), abgerufen am 16. Oktober 2015.
- Club ‚horse‘ drug to be outlawed, BBC-News vom 28. Dezember 2005 (englisch).
- Hayley Dixon: Party drug ketamine to be upgraded to Class B. In: The Daily Telegraph, 12. Februar 2014. Abgerufen am 13. Oktober 2015.